-
下列有关物质性质的比较,不正确的是
A. 金属性:Li>Na>K>Rb B. 酸性:HF<HCl<HBr<HI
C. 微粒半径:K+>Na+>Mg2+>Al3+ D. 酸性:HClO4>H2SO4>H3PO4>H2SiO3
难度: 中等查看答案及解析
-
下列说法中正确的是
A. 电子云通常是用小黑点来表示电子的多少
B. 在同一能级上运动的电子,其运动状态是相同的
C. 能层序数越大,s电子云的半径越大
D. 电子仅在激发态跃迁到基态时才会产生原子光谱
难度: 简单查看答案及解析
-
在通常条件下,下列各组物质的性质排列正确的是
A. Na、Mg、Al的第一电离能逐渐增大
B. 热稳定性:HF>H2O>NH3
C. S2﹣、Cl﹣、K+的半径逐渐增大
D. O、F、Ne的电负性逐渐增大
难度: 中等查看答案及解析
-
用VSEPR模型预测下列分子或离子的立体结构,其中正确的是
A.H2O与BeCl2为V形
B.CS2与SO2为直线形
C.BF3与PCl3为三角锥形
D.SO3与CO为平面三角形
难度: 中等查看答案及解析
-
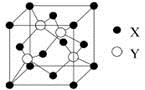
设NA为阿伏加德罗常数的值,下列叙述错误的是
A.1.8g18O2分子与1.8g18O3分子中含有的中子数不同
B.7.8gNa2S和7.8g Na2O2中含有的阴离子数目均为0.1NA
C.23.4 g NaCl晶体中含有0.1NA个如图所示的结构单元
D.含16 g氧原子的二氧化硅晶体中含有的δ键数目为2NA
难度: 中等查看答案及解析
-
有关杂化轨道理论的说法不正确的是
A.杂化轨道全部参加形成化学键
B.杂化前后的轨道数不变,但轨道的形状发生了改变
C.sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180°
D.四面体形、三角锥形的结构可以用sp3杂化轨道解释
难度: 中等查看答案及解析
-
下列溶液中不存在配位键的是
A.CuSO4水溶液 B.银氨溶液
C.硫氰化铁溶液 D.I2的CCl4溶液
难度: 简单查看答案及解析
-
下列说法错误的是
A.离子晶体在熔化状态下一定能导电
B.分子晶体的状态变化只需克服分子间作用力
C.金属键的本质是金属离子与自由电子间的相互作用
D.原子晶体中只存在非极性共价键
难度: 简单查看答案及解析
-
能够用键能解释的是
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液体,碘为固体
C.稀有气体一般很难发生化学反应
D.硝酸易挥发,硫酸难挥发
难度: 简单查看答案及解析
-
下列对一些实验事实的解释正确的是
选项
实验事实
解释
A
水加热到较高温度都难以分解
水分子间存在氢键
B
白磷为正四面体分子
白磷分子中P-P键间的键角是109°28′
C
用苯萃取碘水中的I2
苯和I2均为非极性分子,且苯与水互不相溶
D
H2O的沸点高于H2S
H-O键的键长比H-S键的键长短
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
沸腾时只需克服范德华力的液体物质是
A.水 B.酒精 C.溴 D.水银
难度: 简单查看答案及解析
-
可正确表示原子轨道的是
A. 2s B. 2d C. 1px D. 3f
难度: 简单查看答案及解析
-
下列化学用语的书写正确的是
A.羟基的电子式:
B.过氧化氢的电子式:
C.As的原子的特征电子排布式:[Ar]4s14p3
D.基态Mg原子的核外电子排布图:
难度: 中等查看答案及解析
-
电负性的大小可以作为判断元素金属性和非金属性强弱的尺度。下列关于电负性的变化规律正确的是( )
A. 周期表从左到右,同周期主族元素的电负性逐渐变大
B. 周期表从上到下,元素的电负性逐渐变大
C. 电负性越大,金属性越强
D. 电负性越小,非金属性越强
难度: 中等查看答案及解析
-
五种短周期元素的某些性质如下表所示,其中W、Y、Z为同周期元素,下列说法正确的是
元素代号
X
W
Y
Z
Q
原子半径(×10-12m)
37
64
66
70
154
主要化合价
+1
-1
-2
+5、-3
+1
A. Z与X之间形成的化合物具有还原性
B. 由Q与Y形成的化合物中只存在离子键
C. 由X、Y、Z三种元素形成的化合物的水溶液呈碱性
D. Y与W形成的化合物中,Y显负价
难度: 简单查看答案及解析
-
下列物质形成的晶体,化学键种类和作用方式完全相同的同类型晶体是
A. SO2与SiO2 B. CO2与H2O C. NaCl与Li2O D. CCl4与KCl
难度: 中等查看答案及解析
-
根据氢原子和氟原子的核外电子排布,对F2和HF分子中形成的共价键描述正确的是A.两者都为s-s σ 键 B.两者都为p-p σ 键
C.前者为p-p σ 键,后者为s-p σ 键 D.前者为s-s σ 键,后者为s-p σ 键
难度: 中等查看答案及解析
-
从严格意义上讲石墨属于
A. 分子晶体 B. 原子晶体 C. 金属晶体 D. 混合型晶体
难度: 简单查看答案及解析
-
下列说法错误的是
A. C3H8是折线形极性分子
B. 只有过渡金属才能接受电子对形成配合物
C. 乳酸[ CH3CHOHCOOH]中存在一个手性碳原子
D. 已知酸性:HClO2>HClO,是因为HClO2分子中有1个非羟基氧原子,而HClO中非
难度: 中等查看答案及解析
-
与CO32-离子不是等电子体的是
A. NO2 B. BF3 C. SO3 D. NF32+
难度: 简单查看答案及解析
-
氢键既可以存在于分子之间,也可以存在于分子内部的原子团之间,如对硝基苯酚 (
)存在分子间氢键,邻硝基苯酚 (
)存在分子内氢键,。则两者的沸点的高低关系是
A. 前者>后者 B. 前者<后者 C. 前者=后者 D. 无法估计
难度: 简单查看答案及解析
-
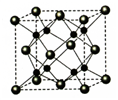
如图,氮化硼晶体有两种。关于这两种晶体的说法正确的是

A. 立方相氮化硼含有σ键和π键,所以硬度大
B. 六方相氮化硼层间作用力小,所以质地软
C. <span style="color: rgb(169, 68, 66); font-size: 15.3333px; text-align: justify; background-color: rgb(245, 245, 245);">两种晶体中存在的作用力均为共价键</span>
D. 两种晶体均为分子晶体
难度: 困难查看答案及解析
-
下列关于CaF2的表述正确的是
A. Ca2+与F-间仅存在静电吸引作用
B. F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
C. 阴阳离子比为2:1的物质,均与CaF2晶体构型相同
D. CaF2中的化学键为离子键,因此CaF2在晶体状态下能导电
难度: 中等查看答案及解析
-
下列关于CH4和CO2的说法正确的是
A. 固态CO2属于原子晶体
B. CH4分子中含有极性共价键,是极性分子
C. 因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
D. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
难度: 中等查看答案及解析
-
胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如下:
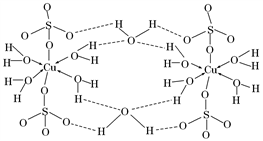
下列说法正确的是
A. 在上述结构示意图中,所有氧原子都采用sp3杂化
B. 在上述结构示意图中,存在配位键、共价键和离子键
C. 胆矾是分子晶体,分子间存在氢键
D. 胆矾中的结晶水,加热时不会分步失去
难度: 中等查看答案及解析