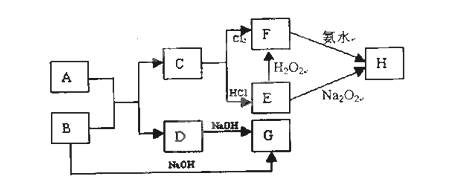
-
下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是( )
① 过滤 ② 蒸发 ③ 溶解 ④ 向容量瓶转移液体
A.①和④ B.①和③ C.①和② D. ③和④
难度: 简单查看答案及解析
-
据中央电视台报道,近年来我国的一些沿江城市多次出现大雾天气,致使高速公路关闭,航班停飞,雾属于下列哪种分散系 ( )
A 乳浊液 B 溶液 C 胶体 D 悬浊液
难度: 简单查看答案及解析
-
铝在空气中能够稳定存在的原因是( )
A.铝的活泼性差
B.铝的还原性差
C.铝与氧气不反应
D.铝表面有氧化膜
难度: 简单查看答案及解析
-
某物质的焰色反应呈黄色,下列判断正确的是( )
A、该物质一定是金属钠 B、该物质一定是钠盐
C、该物质一定含有钠元素 D、该物质一定不含有钾元素
难度: 简单查看答案及解析
-
在下列反应中,既属于离子反应又属于氧化还原反应的是( )
A. BaCl2溶液和K2SO4溶液反应 B. 点燃H2和O2的混合气体
C. NaOH溶液和CuSO4溶液反应 D. Zn放入盐酸中
难度: 简单查看答案及解析
-
下列各组中的离子,能在溶液中大量共存的是( )
A H+ Na+ CO32- Cl- B Ba2+ Na+ Cl- SO42-
C K+ H+ SO42- OH- D Ag+ Al3+ NO3- H+
难度: 简单查看答案及解析
-
下列变化需要加入氧化剂才能实现的是 ( )
A.HCl→H2 B. Ca CO3→CO2 C.CuSO4→Cu D.HCl→Cl2
难度: 简单查看答案及解析
-
下列说法错误的是( )
A. 1mol任何物质都含有约6.02×1023个原子
B. 0.012kg12C约含有6.02×1023个碳原子
C. 使用物质的量时,应用化学式且指明粒子的种类
D. 标准状况下,1mol H2的质量是2g,所占的体积约为22.4L
难度: 简单查看答案及解析
-
浓度为0.01mol·L-1的HCl溶液10mL,加水稀释到20mL,取稀释后的溶液1mL,这1mL溶液中的C(H+) 为 ( )
A.0.0005mol/L B.0.001mol/L C.0.002mol/L D.0.005mol/L
难度: 简单查看答案及解析
-
称取两份铝粉,第一份加足量的NaOH溶液,第二份加足量的盐酸,若放出等量的气体,则两份铝粉的质量比 ( )
A.1:2 B.1:3 C.2:3 D.1:1
难度: 简单查看答案及解析
-
物质的分类通常依据组成和性质,下列对钠的化合物分类,只考虑组成的是( )
A.Na2O2是氧化物,不是碱性氧化物 B.Na2CO3是一种盐,不是碱
C.NaOH是一元碱,强碱 D.NaClO是氧化性盐,含氧酸盐
难度: 简单查看答案及解析
-
下列离子方程式正确的是( )
A.碳酸钙与盐酸反应 CO32 -+ 2 H+ = CO2↑+ H2O
B.金属铁放入稀盐酸中 Fe + 2H+ = Fe2+ + H2↑
C.氯化亚铁溶液中通入氯气 Fe2+ + Cl2 = Fe3+ + 2Cl-
D.金属钠与水反应: Na+H2O=Na++OH-+H2↑
难度: 简单查看答案及解析
-
根据下列反应:(1)2Fe3++2I-=2Fe2++I2(2)Br2+2Fe2+=2Br-+2Fe3+判断离子的还原性由强到弱的顺序是( )
A. Br->Fe2+>I- B. I->Fe2+>Br--
C. Br->I->Fe2+ D. Fe2+>I->Br-
难度: 简单查看答案及解析
-
在FeCl3和CuCl2混合液中,加入过量的铁粉,充分反应后,溶液中的金属离子是( )
A Fe2+ B Fe3+ 和Fe2+ C Cu2+ 和Fe2+ D Cu2+
难度: 简单查看答案及解析
-
下列各组离子在强酸性溶液中能大量共存的是( )
A.Ba2+ Na+ SCN--- Fe3+ B. Mg2+ Cl- Al3+ SO42-
C.K+ Cl- HCO3- NO3- D.Ca2+ Na+ Fe3+ AlO2-
难度: 简单查看答案及解析
-
在Cu2S + 2Cu2O =6Cu + SO2↑反应中(注:Cu2S 和 Cu2O中,Cu为+1价),
下列说法正确的是 ( )
A.生成1molCu,转移2mol电子 B.Cu是氧化产物
C.Cu2S既是氧化剂又是还原剂 D.氧化剂只有Cu2O
难度: 简单查看答案及解析
-
在甲、乙、丙、丁四个烧杯中分别加入2.3gNa、6.2gNa2O、7.8gNa2O2和4.0g NaOH,而后各加入100mL水,搅拌,使固体完全溶解,则甲、乙、丙、丁溶液中物质的量浓度大小顺序正确的是( )
A. 甲=丁<乙<丙 B. 丁<甲<乙=丙
C. 丁<乙=丙<甲 D. 丁<甲<乙>丙
难度: 简单查看答案及解析
-
下列实验装置或操作与粒子的大小无直接关系的是 ( )
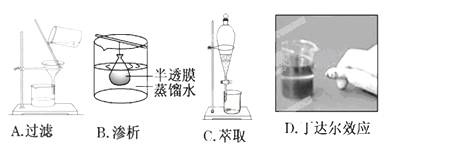
难度: 简单查看答案及解析
-
向MgSO4和Al2(SO4)3的混合溶液中, 逐滴加入NaOH溶液。下列图象中, 能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积, 纵坐标表示反应生成沉淀的质量)( )

难度: 简单查看答案及解析
-
36.5gHCl溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质的量浓度为c mol/L,NA表示阿伏加德罗常数,则下列叙述中正确的是( )
A.所得溶液的物质的量浓度:HCl=1mol/L
B.所得溶液中含有NA个HCl分子
C.常温下,36.5g HCl气体占有的体积一定为22.4L
D.所得溶液的质量分数:ω=36.5c/(1000ρ)
难度: 简单查看答案及解析