-
铋(Bi)与氮同族,氯氧化铋(BiOCl)广泛用于彩釉调料、塑料助剂、油漆调色、生产金属铋等。一种用火法炼铜过程产生的铜转炉烟尘(除含铋的化合物之外,还有CuSO4、ZnSO4、CuS、Fe2O3、PbSO4及As2O3)制备高纯氯氧化铋的工艺流程如下:
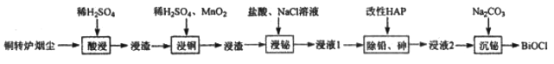
请回答:
(1)Bi位于第六周期,其原子结构示意图为__________________________________。
(2)向“酸浸”所得浸液中加入Zn粉,充分反应后过滤,从溶液中获得ZnSO4·7H2O的操作为__________、过滤、洗涤、干燥。
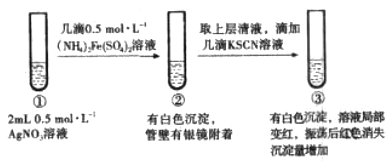
(3)“浸铜”时,有单质硫生成,其离子方程式为____________________________。
(4)“浸铋”时,温度升高,铋的浸出率降低,其原因为____________________________。
(5)“除铅、砷”时,可以采用以下两种方法。
①加入改性HAP。浸液1与HAP的液固比(L/S)与铅、砷去除率以及后续沉铋量的关系如下表:
| L/S | 125:1 | 50:1 | 25:1 | 15:1 |
| Pb2+去除率/% | 84.86 | 94.15 | 95.40 | 96.83 |
| As3+去除率/% | 98.79 | 98.92 | 98.34 | 99.05 |
| m(沉铋)/g | 2.34 | 2.33 | 2.05 | 1.98 |
实验中应采用的L/S=_________________________。
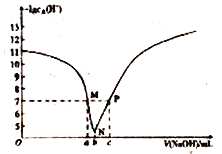
②铁盐氧化法,向浸液1中加入Fe2(SO4)3,并调节pH,生成FeAsO4沉淀。欲使溶液中c(AsO42-)<10-9mol/L且不产生Fe(OH)3沉淀,应控制pH的范围为__________。
已知:1g2=0.3:;FeAsO4、Fe(OH)3的Ksp分别为5×10-23、4×10-38。
(6)“沉铋“时需控制溶液的pH=3.0,此时BiCl3发生反应的化学方程式为___________________。
-
氨气在工农业生产和国防科技中有着重要应用,科研工作者对其进行者广泛研究。回答:
(1)某课题组实现了在常湿常压下,以氮气和液态水为原料制备氨气同时有氧气生成。
已知,在一定温度和压强下,由最稳定的单质生成1mol纯物质的热效应,称为该物质的生成热(△H)。常温常压下、相关物质的生成热如下表所示:
| 物质 | NH3(s) | H20(1) |
| △H/ kJ·mo1-1 | -46 | -242 |
上述合成氨反应的热化学方程式为______________________。
(2)利用生物电池,以H2、N2为原料合成氨的装置如下图所示。
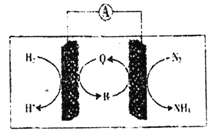
Q、R均为催化剂,据到示判断,负极反应的催化剂为___(填“Q”或“R”);正极的电极反应式为_______________。
(3)氨气是工业制硝酸的主要原料之一,催化氧化步骤中发生的主要反应如下:
I.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)△H=-906kJ/mol
4NO(g)+6H2O(g)△H=-906kJ/mol
II.4NH3(g)+3O2(g) 2N2(g)+ 6H2O(g)△H=-126kJ/mol
2N2(g)+ 6H2O(g)△H=-126kJ/mol
将固定比例NH3和O2的混合气体以一定流速通过填充有催化剂的反应器,反应产率与温度的关系如图1所示。
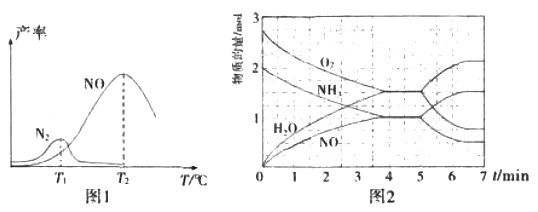
①催化氧化步骤中,最适宜的温度为____(填“T1”或“T2”)。
②低于T1℃时,NO的产率较低的原因为_____。
③高于T2℃时,NO的产率降低的可能原因为_____(填选项字母)
A.催化剂活性降低 B.平衡常数减小 C.反应活化能增大 D.氨气溶于水
④T2℃(T1>T2)时,向20L恒容密闭容器中充入2molNH3和2.75mo1O2,发生反应I.反应过程中各物质的物质的量的随时间(t)变化关系如图2所示。T2℃时,该反应的平衡常数K=_____;5min时,改变了某一外界条件,所改变的条件可能为__________。
-
【化学一选修3:物质结构与性质】铜及其化合物在化工生产中有着广泛的应用。回答下列问题:
(1)铜元素在元素周期表中的位置为_________________,基态Cu原子核外电子占据的原子轨道数为____________________。
(2)向硫酸铜溶液中加入乙二胺(H2N-CH2-CH2-NH3)溶液后,每个Cu2+可与两个乙二胺分子形成四配位离子,导致溶液由蓝色变为紫色。
①乙二胺分子中C、N原子的杂化轨道类型分别为_______________、_________________。
②与硫酸根离子互为等电子体的分子为___________(任写一种)。
③四配位离子的结构式为_____________________,该离子中所有元素的电负性由大到小的顺序为____________________________。
(3)硫化亚铜和氧化亚铜均为离子晶体,其中熔点较高的为___________(填化学式),原因为________________________________________________。
(4)下图为铜与氧(O)、钇(Y)、钡(Ba)形成的一种超导体材料的长方体晶胞结构,其晶胞参数如图(i)所示,该结构中有平面正方形(CuO4)和四方锥(CuO6)结构单元如图(ii)所示。
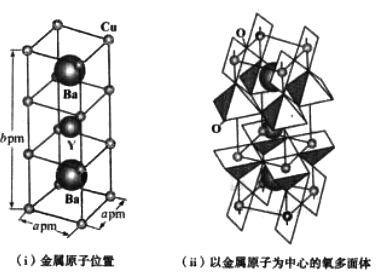
①该超导体材料的化学式为____________________________。
②已知该化合物的摩尔质量为Mg·mol-1,阿伏加德罗常数的值为NA,其密度为____g·cm-3(列出表达式即可)。
-
[化学-选修5:有机化学基础]2017年治疗膀胱癌的有机小分子药物Aminolevulinic acid被批准使用,其合成路线如下:
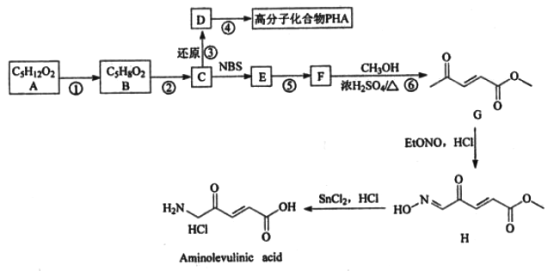
已知:
请回答:
(1)A的名称为________,G中含氧官能团的名称为____________________________。
(2)⑤的反应类型为____________________,H的分子式为_____________________________。(3)①的化学方程式为__________________________________________。
(4)④的化学方程式为______________________________________________。
(5)D的同分异构体中,同时满足下列条件的共有____种(不含立体异构);
a.能与Na反应产生气体
b.既能发生银镜反应,又能发生水解反应
其中核磁共振氧谐有4组峰的物质的结构简式为________________(任写一种)。
(6)参照上述合成路线,设计由2-甲基丙酸和甲醇为起始原料制备2-甲基丙烯酸甲酯的合成路线(无机试剂任选)______________________________________________________。
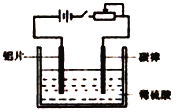
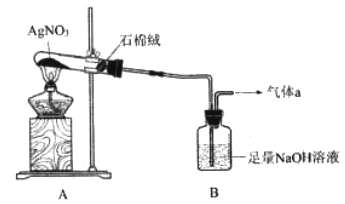
2SO3(g) △H =-198kJ/mol,在V2O5存在时,该反应机理为:V2O5+SO2→2VO3+SO3(快);4VO2+O2→2V2O5(慢)
Fe2O3+SO2↑+SO3↑+14H2O↑。用下图所示装置检验FeSO4·7H2O的所有分解产物,下列说法不正确的是