-
借助碱金属和卤族元素的递变性分析下面的推断,其中正确的是( )
A.已知Ca是第4周期、第ⅡA族的元素,故Ca(OH)2的碱性比Mg(OH)2的碱性弱
B.已知As是第4周期、第ⅤA族的元素,故AsH3的稳定性比NH3的稳定性强
C.已知Cs的原子半径比Na的原子半径大,故Cs与水反应不如Na与水反应剧烈
D.已知Cl的核电荷数比F的核电荷数大,故Cl的原子半径比F的原子半径大
难度: 简单查看答案及解析
-
我国的“神舟五号”载人飞船已发射成功,“嫦娥”探月工程也已正式启动。据科学家预测,月球的土壤中吸附着数百万吨的
,每百吨
核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以
的形式存在。下列说法正确的是
A.
原子核内含有4个质子
B.
和
互为同位素
C.
原子核内含有3个中子
D.
的最外层电子数为2,所以
具有较强的金属性
难度: 中等查看答案及解析
-
下列关于化学观或化学研究方法的叙述中,错误的是( )
A. 在化工生产中应遵循“绿色化学”的思想
B. 在过渡元素中寻找优良的催化剂
C. 根据元素周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4
D. 在元素周期表的金属和非金属分界线附近寻找半导体材料
难度: 中等查看答案及解析
-
下列关于碱金属(IA族的金属元素)元素的叙述中正确的是( )
A. 密度随原子序数的增加而增大
B. 单质与水反应的剧烈程度随原子序数的增加而减弱
C. 氧化物对应的水化物的碱性随原子序数的增加而减弱
D. 化合物中碱金属元素的化合价都是+1。
难度: 中等查看答案及解析
-
简单原子的原子结构可用下图表示方法形象表示:

其中●表示质子或电子,○表示中子,则下列有关①②③的叙述正确的是( )
A. ①②③互为同位素
B. ①②③互为同素异形体
C. ①②③是三种化学性质不同的粒子
D. ①②③具有相同的质量数
难度: 中等查看答案及解析
-
随着卤素原子半径的增大,下列递变规律正确的是( )
A. 单质的熔、沸点逐渐降低 B. 卤素离子的还原性逐渐增强
C. 单质的氧化性逐渐增强 D. 气态氢化物的稳定性逐渐增强
难度: 中等查看答案及解析
-
某些建筑材料含有放射性元素氡(
),会对人体产生一定危害。该原子中中子数和质子数之差是
A. 136 B. 50 C. 86 D. 222
难度: 简单查看答案及解析
-
为了检验某固体物质中是否含有NH
,下列试纸和试剂能用到的是( )
①蒸馏水 ②NaOH溶液 ③红色石蕊试纸 ④蓝色石蕊试纸 ⑤稀硫酸
A. ①②④ B. ①②③ C. ②③ D. ①③⑤
难度: 中等查看答案及解析
-
下列反应中,硝酸既表现酸性,又表现氧化性的是
A. Fe(OH)2跟稀硝酸反应
B. Fe2O3跟稀硝酸反应
C. CuO跟稀硝酸反应
D. Al(OH)3跟稀硝酸反应
难度: 中等查看答案及解析
-
关于硝酸的说法正确的是
A.硝酸电离出的H+离子,能被Zn、Fe等金属还原成H2
B.浓HNO3与浓HCl按3∶1的体积比所得的混合物叫王水
C.硝酸与金属反应时,主要是+5价的氮元素得电子
D.常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体
难度: 困难查看答案及解析
-
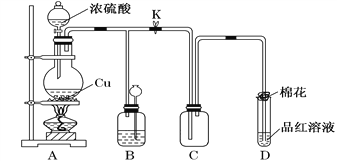
向50 mL 18 mol·L-1的H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量为( )
A. 小于0.45 mol B. 等于0.45 mol
C. 在0.45 mol和0.90 mol之间 D. 等于0.90 mol
难度: 中等查看答案及解析
-
国际无机化学命名委员会在1989年做出决定,把长式元素周期表原先的主副族及族号取消,由左至右改为18列。如碱金属元素为第1列,稀有气体元素为第18列。按此规定,下列说法错误的是( )
A. 第9列元素中没有非金属元素
B. 第1列和第17列元素的单质熔沸点变化趋势相反
C. 在整个18列元素中,第3列的元素种类最多
D. 只有第2列元素原子最外层有2个电子
难度: 中等查看答案及解析
-
在核电荷数为1—20的元素中,最外层电子数和电子层数相等的元素共有( )
A. 3种 B. 4种 C. 5种 D. 6种
难度: 中等查看答案及解析
-
下列各图若为元素周期表的一部分(表中数字为原子序数),其中正确的是( )
A.
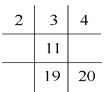 B.
B. 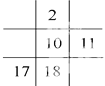 C.
C. 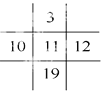 D.
D. 难度: 中等查看答案及解析
-
依据元素周期表及元素周期律,下列推断正确的是 ( )
A. H3BO3的酸性比H2CO3的强
B. Mg(OH)2的碱性比Be(OH)2的强
C. HCl、HBr、HI的热稳定性逐渐增强
D. 若M+和R2-的核外电子层结构相同,则离子半径:M+>R2-
难度: 中等查看答案及解析
-
已知短周期元素的离子aA3+、bB+、cC2-、dD- 都具有相同的电子层结构 ,则下列叙述中正确的是 ( )
A. 原子半径:A>B>D>C B. 原子序数:d>c>b>a
C. 离子半径:C>D>B>A D. 单质的还原性:A>B>D>C
难度: 中等查看答案及解析
-
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是 ( )
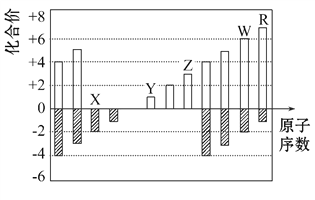
A. 原子半径:Z>Y>X
B. 气态氢化物的稳定性: W>R
C. WX3和水反应形成的化合物的是H2WO3
D. Y和Z两者最高价氧化物对应的水化物能相互反应
难度: 中等查看答案及解析
-
X、Y、Z、W为四种短周期元素,有关这四种元素的说法中正确的是( )
元素
X
Y
Z
W
原子半径(nm)
0.077
0.075
0.102
0.099
最高正价或最低负价
+4
+5
-2
-1
A. 1 mol W的单质参加氧化还原反应时转移的电子数一定为2 mol
B. W、X、Y三种元素的最高价氧化物对应水化物的酸性依次增强
C. Z和W的气态氢化物的稳定性强弱为W>Z
D. 0.3 mol Cu分别与足量HYO3和H2ZO4的稀溶液反应均产生0.2 mol气体
难度: 中等查看答案及解析