-
人造地球卫星用到的一种高能电池--银锌蓄电池,其电池的电极反应式为:Zn+2OH--2e-═ZnO+H2↑,Ag2O+H2O+2e-═2Ag+2OH-.据此判断氧化银是( )
A.负极,被氧化
B.正极,被还原
C.负极,被还原
D.正极,被氧化难度: 中等查看答案及解析
-
下列递变规律正确的是( )
A.O、S、Na、K的原子半径依次增大
B.Na、Mg、Al、Si的金属性逐渐增强
C.HF、HCl、H2S、PH3的稳定性依次增强
D.KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强难度: 中等查看答案及解析
-
提出元素周期律并绘制了第一个元素周期表的科学家是( )
A.戴维
B.门捷列夫
C.阿伏加德罗
D.道尔顿难度: 中等查看答案及解析
-
决定化学反应速率的主要因素是( )
A.反应物的浓度
B.反应温度
C.使用催化剂
D.反应物的性质难度: 中等查看答案及解析
-
已知 2SO2+O2⇌2SO3为放热反应,对该反应的下列说法中正确的是( )
A.O2的能量一定高于SO2的能量
B.SO2和O2的总能量一定高于SO3的总能量
C.SO2的能量一定高于SO3的能量
D.因该反应为放热反应,故不必加热就可发生难度: 中等查看答案及解析
-
镭是元素周期表中第ⅡA族元素,下列关于镭的叙述不正确的是( )
A.镭比钙的金属性更强
B.在化合物中呈+2价
C.镭是一种放射性元素
D.氢氧化镭呈两性难度: 中等查看答案及解析
-
X元素的最高价氧化物对应的水化物的化学式为 H2XO3,则它对应的气态氢化物的化学式为( )
A.HX
B.H2X
C.XH3
D.XH4难度: 中等查看答案及解析
-
过量的锌粉与一定量的稀盐酸反应,为了减慢反应速率,但是又不影响生成的氢气总量,可以采取的措施是( )
A.升高温度
B.加入少量CuSO4溶液
C.加入适量的水
D.加入浓盐酸难度: 中等查看答案及解析
-
下列不能说明氯的非金属性比硫强的事实是( )
①HCl比H2S稳定 ②HClO氧化性比H2SO4强 ③HClO4酸性比H2SO4强 ④Cl2能与H2S反应生成S ⑤Cl原子最外层有7个电子,S原子最外层有6个电子 ⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS ⑦HCl酸性比H2S强.
A.②⑤⑦
B.①②⑦
C.②④
D.①③⑤难度: 中等查看答案及解析
-
下列关于反应限度的叙述不正确的是( )
A.反应限度是一种平衡状态,此时反应已经停止
B.达到平衡状态时,正反应速率和逆反应速率相等
C.达到平衡状态时,反应物和生成物浓度都不再改变
D.不少反应都具有可逆性,只是有的程度小,有得程度大难度: 中等查看答案及解析
-
在核电荷数为1~20的元素中,最外层电子数和电子层数相等的元素共有( )
A.3种
B.4种
C.5种
D.6种难度: 中等查看答案及解析
-
下列反应属于吸热反应的是( )
A.铝与稀硫酸的反应
B.Ba(OH)2.8H2O与NH4Cl的反应
C.甲烷在O2中的燃烧反应
D.盐酸与氢氧化钠的反应难度: 中等查看答案及解析
-
下列物质中,属于共价化合物的是( )
A.NH4Cl
B.H2SO4
C.NaCl
D.I2难度: 中等查看答案及解析
-
下列跟氧气和臭氧的关系相同的一组物质是( )
A.12C和14C
B.氯气和氯水
C.乙醇和酒精
D.H2和H3难度: 中等查看答案及解析
-
某元素的原子核外有三个电子层,M层的电子数是L层电子数的
,则该元素的原子是( )
A.Li
B.Si
C.Al
D.K难度: 中等查看答案及解析
-
在一定温度下,可逆反应A(气)+3B(气)
C(气)若达到平衡的标志是( )
A.C的生成速率与B的生成速率相等
B.A、B、C的浓度不再发生变化
C.A、B、C的分子数之比为1:3:2
D.单位时间内生成Anmol,同时生成B3nmol难度: 中等查看答案及解析
-
两种元素可以组成AB2型离子化合物,它们的原子序数可能是( )
A.11和8
B.6和8
C.7和8
D.12和9难度: 中等查看答案及解析
-
将等质量的两份锌粉a、b中分别加入过量的稀硫酸,同时向a中加少量组成原电池的条件CuS04溶液,下列各图中产生H2的体积V(L)与时间t(min)的关系如图所示,其中正确的是( )
A.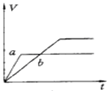
B.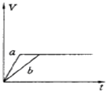
C.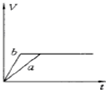
D.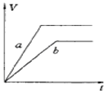
难度: 中等查看答案及解析
 2PbSO4+2H2O:________(充电的过程);
2PbSO4+2H2O:________(充电的过程);