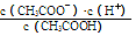-
下列各物质中,不能由组成它的两种元素的单质直接化合得到的是
A.FeS B.FeCl2 C.FeCl3 D.Fe3O4
难度: 中等查看答案及解析
-
H2SO4和HNO3的浓度分别为4mol/L和2mol/L的混合液,取10mL加入过量的铁粉,若HNO3的还原产物为NO,则生成气体在标况下的总体积为
A.0.224L B.0.672L C.0.112L D.0.336L
难度: 中等查看答案及解析
-
下列日常生活中的现象与氧化还原反应无关的是
A.铜铸塑像上出现铜绿[Cu2(0H)2C03]
B.用石膏点豆腐
C.不良商贩用硫黄熏蒸法制作“白豆芽”
D.自来水厂用氯气对水进行消毒
难度: 简单查看答案及解析
-
下列说法正确的是
A.石墨比金刚石稳定,故石墨转化为金刚石的反应可以自发进行
B.吸热反应能自发进行的原因是从外界获得了能量
C.Si02常温下可以与NaOH溶液和HF溶液反应,说明其具有两性
D.反应A(g)+B(g)=2C(s)可以自发进行,则其必为放热反应
难度: 中等查看答案及解析
-
实验表明:将氯水滴加到一张蓝色石蕊试纸上,试纸上会出现如图所示的半径慢慢扩大的内外两个圆环,且两环颜色不同,下列有关说法中不正确的是
A、此实验表明氯水具有酸性、漂白性
B、内环呈白色外环呈红色或浅红色
C、内外环上颜色的差异表明此变化过程中,中和反应比氧化还原反应快
D、氯水中形成次氯酸的反应中还原产物是HClO
难度: 中等查看答案及解析
-
在下列条件下,能大量共存的微粒组是
化学式
电离常数(25℃)
HClO
Ki=3.0ⅹ10-8
H2CO3
Ki1=4.3ⅹ10-7
Ki2=5.6ⅹ10-11
A.c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32-
B.上表提供的数据下:HClO 、HCO3-、ClO-、CO32-
C.能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I-
D.中性的溶液中:CO32-、Na+、SO42-、AlO2-
难度: 困难查看答案及解析
-
赤铜矿的成份是Cu2O,辉铜矿的成份是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:2Cu2O+Cu2S
6Cu+SO2↑,对于该反应,下列说法正确的是
A.该反应的氧化剂只有Cu2O
B.Cu既是氧化产物又是还原产物
C.每生成1 mol Cu,还原剂转移给氧化剂的电子为2 mol
D.该反应中氧化产物与还原产物的质量比为1∶6
难度: 中等查看答案及解析
-
能用
表示的化学反应是
A.氢氧化铁和稀盐酸反应
B.氨水和稀硫酸反应
C.氢氧化钠溶液和稀硝酸反应
D.二氧化碳通入澄清石灰水
难度: 简单查看答案及解析
-
下列说法错误的是
A.萃取操作时,选择有机萃取剂,溶质在萃取剂的溶解度必须比水大
B.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
C.蒸馏操作时,应使温度计水银球插入混合溶液的液面下
D.配制一定物质的量浓度的溶液时,洗涤烧杯和玻璃棒的溶液必须转入容量瓶中
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值。下列叙述正确的是
A.1molFeCl3跟沸水反应转化成氢氧化铁胶体后,生成胶体微粒的数目为NA
B.电解精炼铜时,若转移了NA个电子,则阴极析出32 g铜
C.6.8克熔融的KHSO4中含有0.1NA个阳离子
D.标准状况下,11.2L四氯化碳所含分子数为0.5NA
难度: 中等查看答案及解析
-
下列离子方程式不正确的是
A、将一小粒金属钠放入水中:2Na+2H2O=2Na++2OH-+H2↑
B、将氯气通入氢氧化钠溶液中:Cl2+2OH-=C1-+C1O-+H2O
C、向CuSO4溶液中加入适量Ba(OH)2溶液:Ba2++SO42-=BaSO4↓
D、氯气通入水中:Cl2+H2O
H++HClO+Cl-
难度: 中等查看答案及解析
-
镁粉是制备焰火的原料,工业上通过冷却镁蒸气制得镁粉。下列气体中可以用冷却镁蒸气的是
A.空气 B.二氧化碳 C.氧气 D.氩气
难度: 中等查看答案及解析
-
下列有关化学用语正确的是
①乙烯的最简式C2H4 ②乙醇的结构简式C2H6O
③四氯化碳的电子式
④乙炔的结构简式CHCH
⑤乙烷的结构式CH3CH3 ⑥乙醛的结构简式CH3COH
A.全对 B.全错 C.③④⑤ D.③④⑥
难度: 中等查看答案及解析
-
下列说法中不正确的是
A.HF稳定性比HCl强
B.Mg失电子能力比Ca弱
C.NaCl与NH4Cl含有的化学键类型相同
D.等物质的量的C2H6和H202含电子数相同
难度: 简单查看答案及解析
-
关于Li、Na、K、Rb、Cs的叙述均正确的一组是
①金属性最强的是铯 ②它们的氧化物都只有M20和M202两种形式
③在自然界中均以化合态形式存在 ④密度按Li—Cs顺序依次递增
⑤离子半径:Rb+>K+>Na+
A.①②③ B.①③④⑤ C.②④⑤ D.①③⑤
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,22.4 L NO与11.2 L O2充分反应后得到的气体分子数为NA
B.3.6 g重水中含有的中子数为2NA
C.一定条件下,6.4 g铜与过量的硫反应,转移电子数目为0.2NA
D.常温下,1 L 1 mol·L-1的CH3COOH溶液中,所含溶质分子数小于NA
难度: 中等查看答案及解析
-
下列实验对应的结论不正确的是

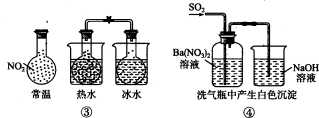
A.①能组成Zn-Cu原电池
B.②能证明非金属性Cl>C>Si
C.③能说明
 △H<0
△H<0D.④中自色沉淀为BaS04
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.用氢氧化钠溶液吸收二氧化氮:2OH-+2NO2===NO3-+NO↑+H2O
B.碳酸氢钠溶液与过量的澄清石灰水反应:2HCO3-+Ca2++2OH-===CaCO3↓+CO32-+2H2O
C.用浓盐酸酸化的KMnO4溶液与H2O2反应:2MnO4-+6H++5H2O2===2Mn2++5O2↑+8H2O
D.硫酸氢钠溶液与足量氢氧化钡溶液混合:H++SO42-+Ba2++OH-===BaSO4↓+H2O
难度: 困难查看答案及解析
-
下列推断正确的是
A.由H+(aq)+OH-(aq)=H20(1) △H=-57.3 kJ·mol-1,可知含1 mo1 CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量为57.3 kJ
B.由C(石墨)=C(金刚石) △H=+1.9 kJ·mol-1,可知石墨比金刚石更稳定
C.由N2(g)+3H2(g)=2NH3(g) △H=-92.4 kJ·mol-1,可知将1 mol N2(g)和3 mol H2(g)置于密闭容器中充分反应后放出热量为92.4 kJ
D.由△G=△H-T△S可知,所有的放热反应都能自发进行
难度: 中等查看答案及解析
-
A与B在容积为1 L的密闭容器中发生反应:aA(s)+bB(g)
cC(g)+dD(g),t1,、t2时刻分别测得部分数据如下表:
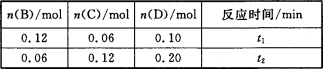
下列说法正确的是
A.0~t1时间段内,平均反应速率v(B)=O.04/t1 mol·(L·min)-1
B.若起始时n(D)=0,则t2时v(D)=0.20/t2 mol·(L·min)-1
C.升高温度,v(B)、vC)、v(D)均增大
D.b:d=6:1
难度: 中等查看答案及解析