-
化学与生活、生产、社会息息相关。下列有关说法不正确的是
A. 古成语“刀耕火耨”,其化学原理是以灰肥田,并可以有效降低土壤的酸度
B. 东汉蔡伦用树皮、破渔网、破布、麻头等作为原料,制造成较低成本的书写纸,史称“蔡侯纸”。“蔡侯纸”的主要成分可能是天然纤维
C. 《本草纲目》中“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次……价值数倍也”用到的实验方法是蒸馏
D. 《本草经集注》中记载了利用“焰色反应”区分硝石和芒硝的方法:“以火烧之,紫青烟起,乃真硝石也”。“真硝石”是碳酸钾
难度: 中等查看答案及解析
-
下列实验操作、现象、解释或结论都正确的是
选项
实验操作
实验现象
解释或结论
A
将少量浓硝酸分多次加入Cu和稀硫酸的混合液中
产生红棕色气体
硝酸的还原产物是NO2
B
某粉末用酒精润湿后,用铂丝蘸取做焰色反应
火焰呈黄色
该粉末一定是钠盐
C
向新生成的AgCl浊液中滴入KI溶液
白色沉淀逐渐转化为黄色沉淀
Ksp(Agl)<Ksp(AgCl)
D
将少量牛油加入到纯碱溶液中,加热一段时间
液体不分层
油脂可直接与纯碱反应
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
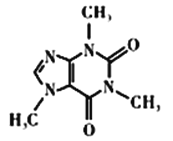
阿斯巴甜(Aspartame,结构简式如图所示)具有清爽的甜味,甜度约为蔗糖的200倍。下列有关说法不正确的是

A. 阿斯巴甜在一定条件下既能与酸反应、又能与碱反应
B. 分子式为C14H18N2O3,阿斯巴甜属于蛋白质
C. 1mol 阿斯巴甜分子可消耗 3 mol NaOH
D. 一定条件下阿斯巴甜的水解产物中有两种氨基酸
难度: 简单查看答案及解析
-
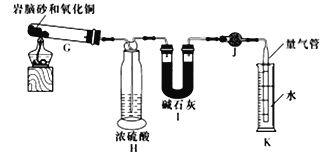
草酸亚铁晶体(FeC2O4·2H2O)是一种淡黄色粉末,某课外小组利用下列装置检验草酸亚铁晶体受热分解的部分产物。

下列说法正确的是
A. 若③和⑤中分别盛放足量NaOH溶液和CuO,可检验生成的CO
B. 通入N2的主要目的是防止空气中的CO2对产物检验产生影响
C. 若将④中的无水CaCl2换成无水硫酸铜可检验分解生成的水蒸气
D. 实验结束后,①中淡黄色粉未完全变成黑色,则产物一定为铁
难度: 中等查看答案及解析
-
如图所示是一种利用锂电池“固定CO2”的电化学装置,在催化剂的作用下,该电化学装置放电时可将CO2转化为C 和Li2CO3充电时选用合适催化剂,只有Li2CO3发生氧化反应,释放出CO2和O2。下列说法中正确的是
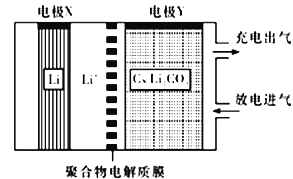
A. 该电池放电时,Li+向电极X 方向移动
B. 该电池充电时,每转移0.4mol电子,理论上阳极产生4.48L.CO2
C. 该电池放电时,每转移4mol电子理论上生成1molC
D. 该电池充电时,阳极反应式为C+2Li2CO3-4e-==3CO2↑+4Li+
难度: 中等查看答案及解析
-
W、X、Y、Z是原子序数依次增大的短周期主族元素。已知W存在多种同素异形体,其中一种是二维纳米材料,被认为是未来革命性材料;X的氢化物是人类生存的重要资源;Y原子最外层电子数等于电子层数;Z离子在同周期最简单阴高子中,半径最小。下列说法正确的是
A. X和Z形成的某种二元化合物可用于自来水的杀菌消毒
B. 最简单离子半径:X>Y>Z
C. W的氢化物的熔沸点一定低于同族元素的氢化物
D. 将Y、Z形成的化合物的水溶液蒸干后得到Y2X3
难度: 中等查看答案及解析
-
H2RO3是一种二元酸,常温下,用1L lmol/LNa2RO3溶液吸收RO2 气体,溶液的pH随RO2气体的物质的量的变化如图所示。下列说法不正确的是
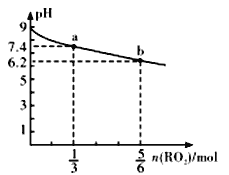
A. a点溶液中2c(Na+)>3c(RO32-)
B. 向b点溶液中加水可使溶液的pH由6.2升高到7.4
C. 常温下,NaHRO3溶液中c(HRO3-)>c(RO32-)>c(H2RO3)
D. 当吸收RO2 的溶液呈中性时,c(Na+)=2c(RO32-)+c(HRO3-)
难度: 困难查看答案及解析
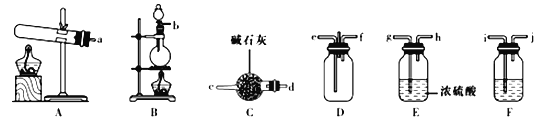


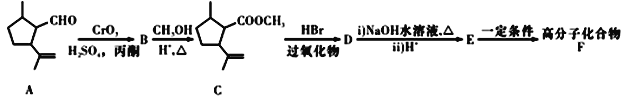
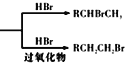
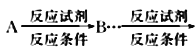 目标产物。__________________
目标产物。__________________