-
下列表示物质结构的化学用语或模型正确的是
A.HF的电子式:
B.O的核外电子排布:
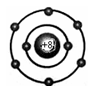
C.S2-离子的结构示意图:
D.CH4分子的球棍模型:
难度: 中等查看答案及解析
-
下列判断正确的是
A.酸性氧化物都能与水反应生成对应的酸
B.晶体中一定存在化学键
C.碱性氧化物一定是金属氧化物
D.非金属氧化物一定是酸性氧化物
难度: 中等查看答案及解析
-
应用元素周期律,判断下列语句,其中正确的组合是
①金属单质Li、Na、K的熔点随原子序数的增大而升高
②砹(At)是第VIIA族,其氢化物的稳定性小于HC1
③硒(Se)是第VIA族,其最高价氧化物对应水化物的酸性比硫酸弱
④第二周期非金属元素的气态氢化物溶于水后,其水溶液均为酸性
⑤铊(TI)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
⑥第三周期金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱
A.①③④ B.①③⑥ C.③④⑤ D.②③⑥
难度: 中等查看答案及解析
-
已知NH3和HCl都能用来作喷泉实验的气体,若在同温同压下用等体积烧瓶各收集满NH3和HCl气体,实验后二个烧瓶内溶液的关系是(两烧瓶内充满溶液且不考虑溶质的扩散)
A.溶质的物质的量浓度相同、溶质的质量分数不同
B.溶质的质量分数相同,溶质的物质的量浓度不同
C.溶质的物质的量浓度和溶质的质量分数都不同
D.溶质的物质的量浓度和溶质的质量分数都相同
难度: 中等查看答案及解析
-
由实验事实得出的结论,其中正确的是
实验事实
结论
A
NH3的水溶液能导电
NH3是电解质
B
SO2通入硝酸钡溶液出现白色沉淀
BaSO3不溶于强酸
C
Ca(ClO)2溶液中通入CO2产生白色沉淀
酸性:H2CO3 >HClO
D
Na2SiO3溶液中滴入盐酸,产生白色沉淀
非金属性:Cl>Si
难度: 中等查看答案及解析
-
下列实验操作或装置符合实验要求的是
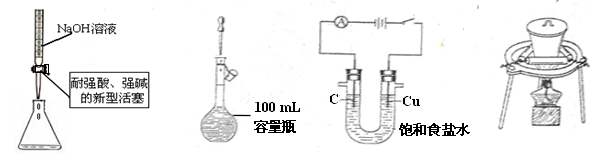
A.量取15.00 mL NaOH溶液 B.定容
C.电解制Cl2和H2 D.高温煅烧石灰石
难度: 中等查看答案及解析
-
下列各组物质中,两者互为同分异构体的是:
①CuSO4·3H2O和CuSO4·5H2O ②NH4CNO和CO(NH2)2
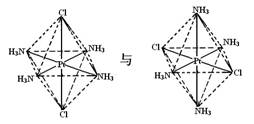 ③C2H5NO2和NH2CH2COOH
③C2H5NO2和NH2CH2COOH④
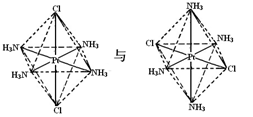
A. ①②③ B. ②③④ C. ②③ D. ③④
难度: 中等查看答案及解析
-
下列离子组一定能大量共存的是
A.能使PH试纸变红的溶液中:Fe2+、Cl-、NO3-、Na+
B.石蕊呈红色的溶液中:Na+、AlO2-、NO3-、Cl-
C.含大量Al3+的溶液中:K+、Na+、NO3-、HCO3-
D.由水电离的c(OH-)=10-13 mol·L-1的溶液中:Ba2+、Cl-、Na+、Br-
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.在KHSO4溶液中加入氢氧化钡溶液至SO42-沉淀完全:
Ba2++OH-+H++SO42-=BaSO4↓+H2O
B.Na2O2与H2O反应生成O2 :Na2O2 + H2O = 2Na+ + 2OH- + O2↑
C.将氯气溶于水制备次氯酸:Cl2 + H2O = 2H+ + Cl- + ClO-
D.用惰性电极电解饱和氯化镁溶液:2Cl-+ 2H2O
2OH- + H2↑+ Cl2↑
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数。下列有关叙述正确的是
A.标准状况下,2.24 L H2O含有的分子数等于0.1 NA
B.常温下,100 mL 1 mol/L Na2CO3溶液中阴离子总数大于0.1 NA
C.分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
D.3.4 g NH3中含N-H键数目为0.2 NA
难度: 中等查看答案及解析
-
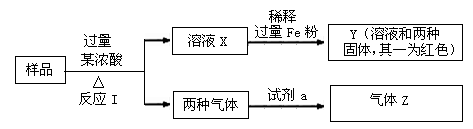
香烟烟雾中含有CO、CO2、SO2、H2O等气体,用①无水CuSO4、②澄清石灰水、③红热CuO、④生石灰、⑤品红溶液等试剂可将其一一检出,(设待检气体为G,气体通过每一种试剂时相关物质的吸收均是完全的)检测时使用试剂的正确顺序是
A.G→①→⑤→④→②→③ B.G→①→⑤→③→④→②
C.G→①→⑤→②→④→③ D.G→①→⑤→②→③→④
难度: 中等查看答案及解析
-
.向20.00mL稀氨水中逐滴加入等物质的量浓度的盐酸,下列示意图变化趋势正确的是
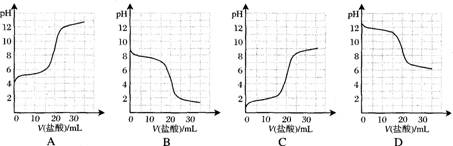
难度: 中等查看答案及解析
-
某同学将少量硝酸铜固体放入试管中加热,使它按:2Cu(NO3)2===2CuO+4NO2↑+O2↑分解。分解后立即将带火星的木条插入试管中,木条复燃。该同学对实验现象解释正确的是
A.NO2不支持燃烧,木条复燃只是由于反应中产生的O2所致
B. 只要混合气体中有氧气,带火星的木条就能复燃
C.Cu(NO3)2分解产生的气体中氧气含量比空气中高,所以木条复燃
D. NO2和O2均能支持燃烧,木条复燃是NO2和O2共同作用的结果
难度: 中等查看答案及解析
-
Na2FeO4是一种高效多功能水处理剂,应用前景广阔,一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2==2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法不正确的是
A.Na2O2在反应中只作氧化剂
B.O2是氧化产物
C.Na2FeO4既是氧化产物又是还原产物
D.2 mol FeSO4发生反应时,共有10 mol电子转移
难度: 中等查看答案及解析
-
短周期的A、B两种元素,A原子半径小于B的原子半径,两种元素可形成A是正价的AB2型化合物。下列关于两元素的叙述正确的是
①A、B可能属于同一周期②A是B的前一周期元素;
③A只能是金属元素; ④A可能是第二周期IIA族或IVA族元素
A.①③ B.②③ C.②④ D.②③④
难度: 中等查看答案及解析
-
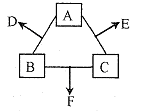
现有碳酸钠、碳酸氢钠、氢氧化钠、硫酸和氢氧化钡五种物质的溶液,它们之间有如图所示转化关系,图中每条线两端的物质可以发生反应,下列判断不合理的是
A.X一定是氢氧化钠溶液 B.Y一定是硫酸溶液
C.Z可能为碳酸钠溶液
D.M、N必定各为碳酸氢钠、氢氧化钡溶液中的某一种
难度: 中等查看答案及解析