-
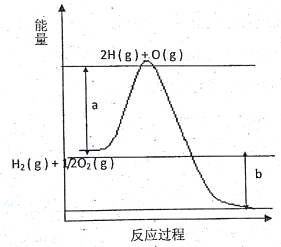
已知:H2(g)+F2(g)=2HF(g)△H=-270kJ·mol-1,下列说法正确的是
A. 2L氟化氢气体分解成1L氢气与1L氟气吸收270kJ热量
B. 1mol氢气与1mol氟气反应生成2mol液态氟化氢放出热量小于270kJ
C. 在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D. 1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270kJ热量
难度: 中等查看答案及解析
-
已知:(1)H2(g)+1/2O2(g)===H2O(g) ΔH1=akJ/mol
(2)2H2(g)+O2(g)===2H2O(g) △H2=bkJ/mol
(3)H2(g)+1/2O2(g)===H2O(l) △H3=ckJ/mol
(4)2H2(g)+O2(g)===2H2O(l) △H4=dkJ/mol
下列关系式中正确的是( )
A. a<c<0 B. b>d>0 C. 2a=b<0 D. 2c=d>0
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 任何化学反应都伴随有能量变化
B. 化学反应中的能量变化都表现为热量的变化
C. 反应物的总能量高于生成物的总能量时,发生放热反应
D. 反应物的总能量低于生成物的总能量时,发生吸热反应
难度: 中等查看答案及解析
-
已知葡萄糖的燃烧热是 -2804 kJ/mol,当它氧化生成1 g 液态水时放出的热量是
A. 26.0 kJ B. 51.9 kJ C. 155.8 kJ D. 467.3 kJ
难度: 简单查看答案及解析
-
已知:①1 mol H2 分子中化学键断裂时需要吸收 436kJ 的能量
②1 mol Cl2 分子中化学键断裂时需要吸收 243kJ 的能量
③由H原子和Cl原子形成1mol HCl分子时释放 431kJ 的能量
则下列叙述正确的是( )
A. 氢气和氯气反应生成氯化氢气体的热化学方程式是 H2(g) + Cl2(g) = 2HCl(g)
B. 氢气和氯气反应生成 2 mol 氯化氢气体,反应的△H =-183kJ/mol
C. 氢气和氯气反应生成 2 mol 氯化氢气体,反应的△H = 183kJ/mol
D. 氢气和氯气反应生成 1 mol 氯化氢气体,反应的△H =-183kJ/mol
难度: 中等查看答案及解析
-
将V1 mL 1.00 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是

A. 做该实验时环境温度为22℃ B. 该实验表明化学能可能转化为热能
C. NaOH溶液的浓度约为1.0 mol/L D. 该实验表明有水生成的反应都是放热反应
难度: 简单查看答案及解析
-
对处于化学平衡的体系,以化学平衡与化学反应速率的关系可知
A. 正反应进行的程度大,正反应速率一定大
B. 化学平衡发生移动时,化学反应速率一定变化
C. 化学反应速率变化时,化学平衡一定发生移动
D. 只有催化剂存在下,才会发生化学反应速率变化,而化学平衡不移动的情况
难度: 中等查看答案及解析
-
已知:4NH3+5O2
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O) [mol/(L·min)]表示,则正确的关系式是
A. 4v(NH3)=5v(O2) B. 5 v(O2)=6v(H2O) C. 2 v(NH3)=3v(H2O) D. 4 v(O2)=5v(NO)
难度: 中等查看答案及解析
-
可逆反应:A+3B
2C+2D在4种不同的情况下的反应速率分别为
①v(A )=0.15mol/(L·s) ②v(B )=0.6mol/(L·s) ③v(C )=0.4mol/(L·s) ④v(D )=0.45mol/(L·s)
该反应进行速率最快的是
A. .① B. ②和③ C. ④ D. ①和④
难度: 中等查看答案及解析
-
对处于平衡状态的反应2A(g)+B(g)
2C(g);△H=-QKJ/mol,下列叙述正确的是
A. 增大压强,v(正)增大,v(逆)减小
B. 升高温度,v(正)减小,v(逆)增大
C. 增大A浓度的瞬间,v(正)增大,v(逆)不变
D. 增大A浓度的瞬间,v(正)增大而v(逆)减小
难度: 简单查看答案及解析
-
恒温恒压下,在容积可变的器皿中,反应2NO2 (g)
N2O4 (g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
A. 不变 B. 增大 C. 减小 D. 无法判断
难度: 中等查看答案及解析
-
某温度下,反应mA(g)+nB(g)
pC(g)+qD(g)的平衡常数为K,下列说法正确的是:
A.K越大,达到平衡时,反应进行的程度越小
B.K越小,达到平衡时,反应物的转化率越大
C.K随反应物浓度改变而改变
D.K随温度改变而改变
难度: 中等查看答案及解析
-
对于可逆反应A2(g)+3B2(g)
2AB3(g);△H<0,下列图像正确的是:

A. A B. B C. C D. D
难度: 中等查看答案及解析