-
近期伊朗将首批国产的核燃料棒加载到了核反应堆,引起中东局势动荡不安。
U是核电站的主要燃料,下列关于
U的说法正确的是
A.质子数为235 B.中子数为92
C.电子数为143 D.质量数为235
难度: 简单查看答案及解析
-
有关化学用语正确的是
A.次氯酸的电子式:H ∶Cl∶O∶ B.Mg2+的结构示意图:
C.氮气的结构式:∶N≡N∶ D.氯化镁的电子式:
难度: 简单查看答案及解析
-
对于反应中的能量变化,表述正确的是
A.断开化学键的过程会放出能量
B.放热反应中,反应物的总能量大于生成物的总能量
C.加热才能发生的反应一定是吸热反应
D.化合反应均为放热反应
难度: 简单查看答案及解析
-
下列物质中含有共价键的离子化合物是
A.Na2O2 B.MgCl2 C.HCl D.Cl2
难度: 简单查看答案及解析
-
某酸性溶液中,因发生氧化还原反应而不能大量共存的是
A.Ag+、NO3-、Cl-、K+ B.Na+、Fe2+、Cl-、NO3-
C.K+、Ba2+、OH-、SO42- D.Cu2+、NH4+、Br-、Cl-
难度: 简单查看答案及解析
-
下列说法正确的是
A.1H、D、T互为同位素 B.金刚石、石墨、C60互为同分异构体
C.H2O和H2O2互为同素异形体 D.正丁烷和异丁烷互为同素异形体
难度: 简单查看答案及解析
-
下列各组反应(表中物质均为反应物),在反应刚开始时,放出H2的速率最大的是
金属(粉末状)/mol
酸的浓度及体积
反应温度
A
Mg 0.1
3 mol·L-1硝酸10 mL
80 ℃
B
Mg 0.1
1 mol·L-1盐酸10 mL
60 ℃
C
Fe 0.1
1 mol·L-1盐酸 10 mL
60 ℃
D
Mg 0.1
1 mol·L-1硫酸10 mL
60 ℃
难度: 简单查看答案及解析
-
干冰在一定条件下可以形成CO2气体,CO2气体在一定条件下又可以与金属镁
反应生成氧化镁和碳,这两个变化过程中需要克服的作用力分别是
A.化学键,化学键 B.化学键,分子间作用力
C.分子间作用力,化学键 D.分子间作用力,分子间作用力
难度: 简单查看答案及解析
-
如右图,利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,
立即用另一表面皿扣在上面。下列对实验现象所做的解释正确的是
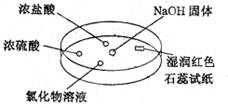
A.浓盐酸附近产生白烟:NH3与HCl气体反应产生了NH4C1固体
B.浓硫酸附近无明显现象:NH3与浓硫酸不发生反应
C.氯化物溶液变浑浊:该溶液一定是A1Cl3溶液
D.湿润的红色石蕊试纸变蓝:NH3的水溶液显碱性
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A.向稀硝酸中加入铜片:Cu+4H++2NO3- = Cu2++2NO2↑+2H2O
B.AlCl3溶液中加入足量的氨水:Al3+ +3OH- = Al(OH)3↓
C.NH4HCO3溶液中加入足量的NaOH溶液:NH4++OH- = NH3↑+ H2O
D.向稀硝酸中加入氧化铁:Fe2O3 + 6H+ = 2Fe3+ +3H2O
难度: 简单查看答案及解析
-
下图所示的实验操作,能达到相应目的的是

难度: 简单查看答案及解析
-
下列说法正确的是
A.过渡元素均为金属元素
B.IA族统称为碱金属,最外层有两个电子的原子一定在IIA 族
C.含离子键的晶体一定是离子晶体,含共价键的晶体一定是分子晶体
D.两种微粒,若核外电子排布完全相同,则其化学性质一定相同
难度: 简单查看答案及解析
-
沼气是一种能源,它的主要成分是CH4。0.5 mol CH4完全燃烧生成CO2和液态水时放出445 kJ的热量,则下列热化学方程式中正确的是
A.2CH4(g)+4O2(g)==2CO2(g)+4H2O(1) △H= +1780 kJ/mol
B.CH4(g)+2O2(g)==CO2(g)+2H2O(l) △H= +890 kJ/mol
C.CH4(g)+2O2(g)==CO2(g)+2H2O(1) △H= —890 kJ/mol
D.
CH4(g)+O2(g)==
CO2(g)+H2O(1) △H= —890 kJ/mol
难度: 简单查看答案及解析
-
在2 L的密闭容器中发生反应:4A(s)+3B(g)===2C(g)+D(g),2 min后B减小了1.2 mol 。有关此反应的说法正确的是
A.用A表示的反应速率是0.4 mol/(L·min)
B.分别用B、C、D表示化学反应速率其比值是3∶2∶1
C.在2 min内的反应速率,用C表示是0.4 mol/(L·min)
D.升高温度,正、逆反应速率都将增大
难度: 简单查看答案及解析
-
可逆反应2NO2
2NO+O2在恒容密闭容器中反应,能说明反应已达到平衡状态的是
①单位时间内生成n mo1 O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n molNO
③混合气体的颜色不再改变
④c(NO2)∶c(NO)∶c(O2)=2∶2∶1
⑤混合气体的压强保持不变
⑥各物质的浓度相等
A.①③⑤ B.②④⑤⑥ C.①③④⑤⑥ D.①②③④⑤⑥
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,4.48 L NO和2.24 L O2混合气体中含分子总数为0.3NA
B.25℃,1.01×105 Pa, 32 g O2和O3的混合气体中含原子总数为2NA
C.标准状况下,17 g NH3和22.4 L H2O中均含有10NA个电子
D.1mol Na2O2中含离子总数为4NA
难度: 简单查看答案及解析
-
短周期主族元素A、B、C、D原子序数依次增大。A、C的原子序数的差为8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是
A.原子半径:A<B<C<D B.C单质在常温下为气态
C.D单质在工业上的用途之一是制漂白粉 D.B的氧化物为碱性氧化物
难度: 简单查看答案及解析
-
标准状况下,将NO2和NO组成的混合气体4.48L通入100mL水中,充分反应后,气体体积缩小为2.24L,假设溶液的体积不变,则下列说法中不正确的是
A.所得溶液中溶质物质的量浓度为1.0 mol·L-1
B.原混合气体中NO2和NO的体积比为1∶1
C.反应过程中转移的电子总数为0.1mol
D.若将原混合气体和1.68 L(标准状况)O2混合后再通入100 mL水中,则充分反应后,不会有气体剩余
难度: 简单查看答案及解析
