-
化学与能源开发、环境保护、资源利用等密切相关.下列说法正确的是( )
A.为提高农作物的产量和质量,应大量使用化肥和农药
B.绿色化学的核心是应用化学原理对环境污染进行治理
C.实现化石燃料清洁利用,就无需开发新能源
D.垃圾是放错地方的资源,应分类回收利用难度: 中等查看答案及解析
-
下列说法中,不正确的是( )
A.合金材料中可能含有非金属元素
B.蛋白质、纤维素、淀粉、油脂都是高分子化合物
C.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
D.红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO、Cl-
B.pH=1的溶液中:Fe2+、NO、SO
、Na+
C.c(Fe3+)=0.1mol•L-1的溶液中:K+、ClO-、SO42-、SCN-
D.由水电离的c(H+)=1×10-14mol•L-1的溶液中:Ca2+、K+、Cl-、HCO难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.1molCu与足量稀硝酸反应产生NA个NO分子
B.含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol.L-1
C.常温下,1L0.1mol.L-1的NH4NO3溶液中氮原子数为0.2NA
D.在反应KIO3+6HI═KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA难度: 中等查看答案及解析
-
25℃时,某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子,则下列描述正确的是( )
A.加入适量氨水,c(CH3COO-)一定大于c(Na+)与c(NH4+)之和
B.加入适量NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.该溶液可由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
D.该溶液可由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合而成难度: 中等查看答案及解析
-
可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极.下列说法正确的是( )
A.电池工作时,电子通过外电路从正极流向负极
B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-═Al(OH)3↓
C.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-═4OH-
D.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变难度: 中等查看答案及解析
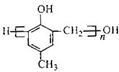 )的合成路线如下:
)的合成路线如下: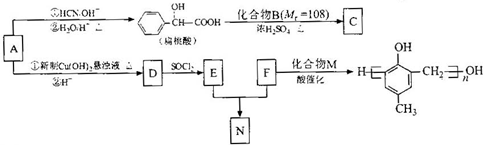

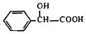 )有多种同分异构体.属于甲酸酯且含酚羟基的同分异构体共有______种,写出其中一种含亚甲基(-CH2-)的同分异构体的结构简式______.
)有多种同分异构体.属于甲酸酯且含酚羟基的同分异构体共有______种,写出其中一种含亚甲基(-CH2-)的同分异构体的结构简式______.