-
下列说法正确的是
A.相对分子质量相同的几种化合物互称为同分异构体
B.可用酒精从碘水中萃取碘
C.甲基的电子式:
D.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
难度: 简单查看答案及解析
-
已知丙酮通常是无色液体,不溶于水 ,密度小于1g/cm3,,沸点55℃,从水与丙酮的混合物中将丙酮分离出来,下列方法中最合理的是
A 、蒸馏 B、分液 C、过滤 D 、蒸发
难度: 简单查看答案及解析
-
已知在1×105Pa、298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
A.H2O(g)=H2(g)+1/2 O2(g); △H= +242kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l); △H= -484kJ·mol-1
C.H2(g)+1/2 O2(g)=H2O(g); △H= +242kJ·mol-1
D.2H2(g)+O2(g)=2H2O(g); △H= -242kJ·mol-1
难度: 简单查看答案及解析
-
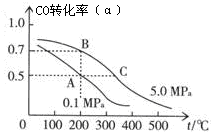
在一固定容积的容闭容器中,加入2 L X 和3 L Y 气体,发生如下反应:
n X(g) + 3Y(g)
2Z(g) + R(g),反应平衡时,则知X 和Y 的转化率分别为30%和60%,
则化学方程式中的n 值为
A.1 B.2 C.3 D.4
难度: 简单查看答案及解析
-
某小组为研究电化学原理,设计如图2装置。下列叙述不正确的是( )
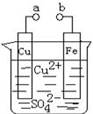
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
难度: 简单查看答案及解析
-
化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A.氧化铝的熔点很高,可用于制作耐高温材料
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.电解氯化镁饱和溶液,可制得金属镁
D.明矾水解形成的胶体能吸附水中悬浮物,可用于水的净化
难度: 简单查看答案及解析
-
下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向
正反应方向移动
②已达平衡的反应N2(g)+3H2(g)
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应达平衡时,若减小反应器容积,平衡向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①②④ B.①②③ C.②③④ D.①②③④
难度: 简单查看答案及解析
-
下列说法正确的是
A.某有机物的结构简式为:
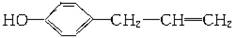 ,按官能团分,既可属于醇类,也可属于烯类
,按官能团分,既可属于醇类,也可属于烯类B.
的名称为2-甲基-3-丁烯
C.用分液的方法分离乙酸和乙酸乙酯
D.用重结晶的方法提纯苯甲酸
难度: 简单查看答案及解析
-
下列化合物中,核磁共振氢谱只出现两组峰且峰面积之比为3:2的是
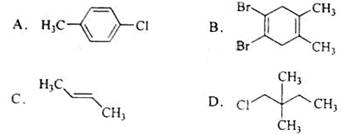
难度: 简单查看答案及解析
-
下列说法不正确的是
A.铅蓄电池在放电过程中,负极质量减小,正极质量增加
B.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH>0
C.钢铁在潮湿的空气中会形成原电池而被腐蚀,其正极反应为:O2 + 2H2O + 4e-=4OH-
D.原子结合成分子的过程一定释放出能量
难度: 简单查看答案及解析
-
25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是
A.c(NH4+)<c(SO42-) B.2c(NH4+)=c(SO42-)
C.c(NH4+)>c(SO42-) D.c(OH-)+ c(SO42-) = c(NH4+)+c(H+)
难度: 简单查看答案及解析
-
下列四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;
④pH=12的NaOH溶液。相同条件下,有关上述溶液的比较中,正确的是 ( )
A.由水电离的c(H+):①=②>③=④
B.将②、③两种溶液混合后,若pH=7,则消耗溶液的体积:②>③
C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
D.向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>①>②
难度: 简单查看答案及解析
-
关于下列各装置图的叙述中,不正确的是
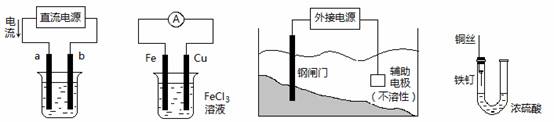 ① ② ③ ④
① ② ③ ④A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀
难度: 简单查看答案及解析
-
右图为用一定物质的量浓度的NaOH溶液滴定10mL一定物质的量浓度的盐酸的图示。
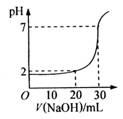
依据图示,推出盐酸和NaOH的物质的量浓度是
物质的量浓度(mol/L)
A
B
C
D
c(HCl)
0.12
0.04
0.03
0.09
c(NaOH)
0.04
0.12
0.09
0.03
难度: 简单查看答案及解析
-
已知可逆反应X(g)+Y(g)
Z(g)(未配平)。温度为T0时,在容积固定的容器中发生反应各物质的浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
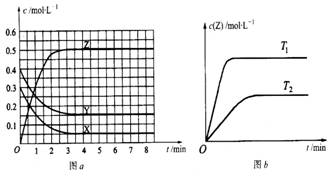
A.发生反应时,各物质的反应速率大小关系为:v(X)= v(Y)= 2v(Z)
B.图a中反应达到平衡时,Y的转化率为37.5%
C.T0℃时,该反应的平衡常数为33.3
D.该反应正反应的反应热△H<0
难度: 简单查看答案及解析