-
在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是( )
A.两种气体的压强相等
B.O2比O3质量小
C.两种气体的分子数目相等
D.两种气体的氧原子数目相等难度: 中等查看答案及解析
-
为了加强再生资源的回收管理,节约资源,保护环境.《上海市再生资源回收管理办法》从2012年12月1日起施行.下面是4位同学对一些废品按其主要成分进行的分类,其中错误的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列物质与其用途相符合的是( )
①Cl2一做消毒剂
②AgBr-制胶卷,感光纸
③NaClO-漂白纺织物
④SO2-作防腐荆
⑤淀粉一检验I2的存在
⑥HOCH2CH2OH-抗冻剂.
A.②③④⑤⑥
B.①②③④⑤
C.①②③⑤
D.全部难度: 中等查看答案及解析
-
下列有关化学用语使用正确的是( )
A.NH4Br的电子式:
B.S2-的结构示意图:
C.乙酸的分子式:CH3COOH
D.原子核内有l8个中子的氯原子:Cl
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.离子化合物中一定含有金属元素
B.构成分子晶体的微粒中一定含有共价键
C.原子晶体熔化要破坏共价键
D.只有离子化合物中才存在离子难度: 中等查看答案及解析
-
类比归纳是学习化学的重要方法,对如下类比的说法正确的是( )
A.CO2、SO2部是酸性氧化物,都能使酸性高锰酸钾溶液褪色
B.MgO、Al2O3都是高熔点离子化合物,熔化时都能导电
C.CO2与SiO2都是第IV A族的最高氧化物,则它们的物理性质也相似
D.Al2O3与Fe2O3化学式相似,都是不溶于水的碱性氧化物难度: 中等查看答案及解析
-
下列物质性质的比较,正确的是( )
A.热稳定性:Na2CO3>NaHCO3>H2CO3
B.熔点:K>Na>Li
C.同条件下,同浓度溶液的pH值:NaHCO3>Na2CO3
D.还原性:S2->Br->I-难度: 中等查看答案及解析
-
在一定条什下,下列有机物都能发生加成反应、取代反应、水解反应和中和反应共四种反应的是( )
A.一滴香:
B.芬必得:
C.维生素B5:
D.扑热息痛:
难度: 中等查看答案及解析
-
研制和开发不含碳并可工业生产的清洁能源,一直是科学家不懈追求的目标,目前液氨被人们视为一种潜在的清洁燃料.液氨燃烧的化学反应方程式为:4NH3+3O2→2N2+6H2O.和氢燃料相比有关数据见下表,据此判断正确的是( )
①以氨和氢为燃料时,可以减缓温室效应燃料 沸点(℃) 燃烧热(kJ/mol) 相对分子质量 液态密度(g/cm3) 氢 -252.6 238.40 2.02 0.07 氨 -33.50 317.10 17.03 0.61
②氨泄漏到空气中比氢气更易发生爆炸
③等质量的氨和氢分别燃烧,氢放出的热量少
④氨的液化比氢容易得多.
A.①③
B.②③
C.①④
D.②④难度: 中等查看答案及解析
-
实验室制浓硫酸、浓硝酸的混合物与苯反应制取硝基苯.得到粗产品后,要选用如下几步操作对粗产品进行精制:
①蒸馏
②水洗
③用干燥剂进行干燥
④用10%的NaOH溶液洗涤.
正确的操作步骤是( )
A.①②@④②
B.②④②③①
C.④②③①②
D.③④①②③难度: 中等查看答案及解析
-
阿伏加德罗常数约为6.02×1023mol-1,下列说法中一定正确的是( )
A.1L 1mol•L-1的HAc溶液中含有氢离子数约为6.02×1023
B.18g D2O(重水)完全电解,转移的电子数约为6.02×1023
C.标态下,22.4L NO2气体,所含氧原子数约为2×6.02×1023
D.标态下,14g乙烯和丙烯的混合物中,含有共用电子对数目约为3×6.02×1023难度: 中等查看答案及解析
-
为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是( )
被提纯的物质 除杂试剂 分离方法 A 溴化钠溶液 (NaI) 氯水、CCl4 萃取、分液 B 苯(苯酚) NaOH溶液 过滤 C CO2(HCl) 饱和Na2CO3溶液 洗气 D 乙醇(乙酸) 新制生石灰(CaO) 蒸馏
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2.其反应原理为:
C3N3(OH)33HNCO;8HNCO+6NO2
7N2+8CO2+4H2O.
下列说法止确的是( )
A.C3N3(OH)3与HNCO为同一物质
B.1mol HNCO与NO2反应时转移3mol电子
C.HNCO是强氧化剂
D.反应中CO2是氧化产物难度: 中等查看答案及解析
-
下列叙述不正确的是( )
A.铜锌稀硫酸原电池工作时,电子沿外电路从铜电极流向锌电极
B.船底镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁吸氧腐蚀的正极反应:O2+2H2O+4e→4OH-
D.工业上电解饱和食盐水的阳极反麻:2Cl--2e→C12↑难度: 中等查看答案及解析
-
“封管试验”具有简易、方便、节约、绿色等优点.观察下列四个“封管试验”(夹持装置未画出),判断下列说法正确的是( )

A.加热时,a上部聚集了固体NH4Cl,说明NH4C1的热稳性比较好
B.加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体
C.加热时,c中溶液红色变深,冷却后又变浅
D.水浴时,d内气体颜色变浅,e内气体颜色加深难度: 中等查看答案及解析
-
下列装置或操作与实验目的最相符的是( )
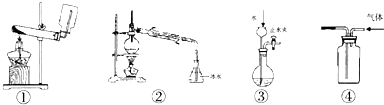
A.①--实验室制取并收集足量NH3
B.②--以溴化钾、90%硫酸、乙醇为原料合成溴乙烷的装置
C.③--检查装置气密性
D.④--利用排空气法收集CO2难度: 中等查看答案及解析
-
取一定量的氧化铁与氧化铜的混合物,加入稀硫酸(含0.1mol H2SO4),恰好完全反应成盐和水原混合物中氧元素的质量是( )
A.6.4g
B.3.2g
C.1.6g
D.0.8g难度: 中等查看答案及解析
-
一定量的锌粒与足量稀硫酸反应,向反应混合液中加入某些物质,下列判断正确的是( )
A.加入少量水,产生H速率减小,H2体积不变
B.加入NH4HSO4固体,产生H2速率不变,H2体积不变
C.加入CH3COONa固体,产生H2速率减小,H2体积减小
D.滴加少量CuSO4溶液,产生H2速率变大,H2体积减小难度: 中等查看答案及解析
-
下列反应的离子方程式错误的是( )
A.等物质的量的Ba (OH)2与NH4HSO4在溶液中反应:Ba2++2OH-+NH4++H++SO42-═BaSO4+NH3•H2O+H2O
B.氢氧化铁与足量的氢溴酸溶液反应:Fe(OH)3+3H+═Fe3++3H2O
C.足量的CO2通入饱和碳酸钠溶液中:CO2+CO32-+H2O═2HCO3-
D.酸性条件下KIO3溶液和KI溶液反应生成I2:IO3-+5I-+3H2O═3I2+6OH-难度: 中等查看答案及解析
-
今有一混合物的水溶液,只可能肯有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀生成;
(2)第二份加足量NaOH溶液后,收集到气体0.05mol;
(3)第三份加足量BaCl2溶液后,得干燥沉淀4.3g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.
根据上述实验,以下推测正确的是( )
A.K+可能存在
B.混合溶液中c(CO32-)为1mol/L
C.Cl-一定存在
D.Ba2+一定不存在,Mg2+可能存在难度: 中等查看答案及解析
-
常温下,取0.3mol/L HY溶液与0.3mol/L NaOH溶液等体积混合(不计混合后溶液体积变化),测得混合溶液的pH=9,则下列说法(或关系式)正确的是( )
A.混合溶液中由水电离出来的c(OH-)=1×10-9mol/L
B.混合溶液中离子浓度大小次序为:c(Y-)>c(Na+)>c(OH-)>c(H+)
C.c(OH-)-c(HY)=c(H+)=1×10-9mol/L
D.c(Na+)=c(Y-)+c(HY)=0.3 mol/L难度: 中等查看答案及解析
-
某结晶水合物的化学式为R•nH2O,其相对分子质量为M.25℃时,将a g该晶体溶于b g H2O中恰好形成V mL饱和溶液.下列表达式正确的是( )
A.饱和溶液物质的量浓度为:1000 a(M-18n) mol/L
B.饱和溶液溶质的质量分数为:
C.25℃时R的溶解度为:g/100 g H2O
D.饱和溶液的密度为:g/mL
难度: 中等查看答案及解析


 ),(俗称尼泊金乙酯)可用作防腐剂,对霉菌有很强的抑制作用.其过程如下:
),(俗称尼泊金乙酯)可用作防腐剂,对霉菌有很强的抑制作用.其过程如下: