-
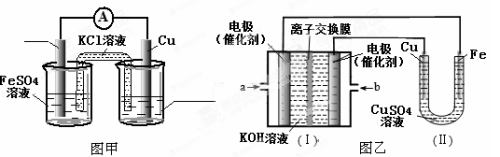
下列说法错误的是
A.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
B.能自发进行的化学反应,焓变和熵变一定符合:△H<0、△S>0
C.将碳酸钠溶液和碳酸氢钠溶液分别蒸干并灼烧,所得固体的成分均为纯碱
D.用FeCl3饱和溶液制Fe(OH)3胶体的过程属于吸热过程
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.将过量的CO2通入Ca(ClO)2溶液中:H2O+CO2+Ca
+2ClO
=CaCO3↓+2HClO
B.将少量NaOH溶液加入到NH4HCO3溶液中:OH-+HCO
=CO
+H2O
C.Fe3O4与稀HNO3反应:Fe3O4+8H
=Fe
+2Fe
+4H2O
D.向NaHCO3溶液中加入少量Ca(OH)2:HCO
+Ca
+OH
=CaCO3↓+H2O
难度: 中等查看答案及解析
-
下列关于阿佛加德罗常数的说法正确的是
A.0.1 NA的NO在一密闭容器中与足量氧气完全反应,得到0.1 mol NO2
B.一定条件下的密闭容器中,6.4 g SO2可被氧气氧化得到SO3的分子数为0.1 NA
C.常温下18 g铝放入足量浓硫酸中转移电子数2 NA
D.1 L 0.1 mol/L FeCl3溶液完全水解得到的Fe(OH)3胶体微粒数小于0.1 NA
难度: 中等查看答案及解析
-
在55 ℃时,下列说法正确的是
A.向水中加入少量硫酸氢钠固体,促进了水的电离,c(H+)增大,Kw不变
B.pH=8的NaHCO3溶液中:c(OH-)=1×10-6mol/L
C.饱和氯水中: c(Cl-)=c(ClO-)+c(HClO)
D.0.1 mol/L的(NH4)2SO4溶液中:c(SO42 -)>c(NH4+ ) >c(H+)>c(OH-)
难度: 简单查看答案及解析
-
现有短周期主族元素X、Y、Z、R、T。R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡。六种元素的原子半径与原子序数的关系如图所示。下列推断正确的是
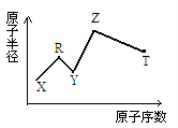
A.原子半径和离子半径均满足:Y<Z
B.氢化物的沸点排序 :Y>T>R
C.最高价氧化物对应的水化物的酸性 :T<R
D.由X、R、Y、Z四种元素组成的化合物水溶液一定显酸性
难度: 中等查看答案及解析
-
某恒温密闭容器中,可逆反应A(s)
B+C(g) ΔH= +Q kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析不正确的是
A.产物B的状态只能为固态或液态
B.平衡时,n(A)消耗﹕n(C)消耗=1﹕1
C.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
D.若开始时向容器中加入1 mol B和1 mol C,达到平衡时放出热量小于Q kJ
难度: 中等查看答案及解析
-
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。
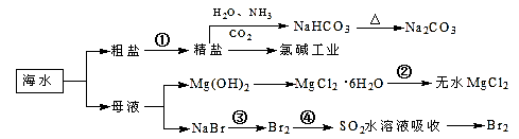
下列有关说法正确的是
A.过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B.步骤④的作用是达到富集溴的目的
C.过程②中MgCl2·6H2O加热脱水制得无水MgCl2
D.工业上电解熔融精盐的过程称为氯碱工业
难度: 中等查看答案及解析