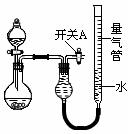
-
分类是化学研究中常用的方法。下列分类方法中,不正确的是( )
①根据元素原子最外层电子数的多少将元素分为金属和非金属
②根据电解质在水溶液中能否完全电离将电解质分为强电解质和弱电解质
③依据组成元素的种类,将纯净物分为单质和化合物
④根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸等
⑤根据氧化物中是否含有金属元素,将氧化物分为碱性氧化物、酸性氧化物
⑥根据分散系的稳定性大小,将分散系分为胶体、浊液和溶液
⑦依据有无电子转移,将化学反应分为氧化还原反应和非氧化还原反应
⑧根据化学反应的热效应,将化学反应分为放热反应、吸热反应
A.①④⑤⑥ B.③④⑤⑥ C.只有①③ D.全部正确
难度: 中等查看答案及解析
-
最近医学界通过用14C标记的C60发现一种C60的羧酸衍生物,在特定条件下可以通过断裂DNA抑制艾滋病毒的繁殖,则有关14C的叙述正确的是( )
A.与12C60的碳原子化学性质不同
B.与14N含的中子数相同
C.是12C60的同素异形体
D.与12C、13C互为同位素
难度: 中等查看答案及解析
-
下列各项操作中不发生先沉淀后沉淀溶解现象的是( )
① 向饱和Na2CO3溶液中通入过量CO2
② 向Fe(OH)3胶体中逐滴滴入过量的H2SO4溶液 ③ 向AgI胶体中逐滴加入过量稀盐酸
④ 向石灰水中通入过量CO2 ⑤ 向Na2SiO3溶液中滴入过量的盐酸
A.①②③ B.②③⑤ C.①②③⑤ D.①③⑤
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.Na2S溶液水【解析】
S2-+H2O=HS-+OH-B.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O
C.向酸性氯化亚铁溶液中加入过氧化氢溶液:2Fe2++H2O2+2H+=2Fe3++2H2O
D.铜与浓硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
难度: 中等查看答案及解析
-
下列实验现象预测正确的是( )

A.实验I:振荡后静置,上层溶液颜色保持不变
B.实验II:酸性KMnO4溶液中出现气泡,且颜色不变
C.实验III:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D.实验IV:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA
B.12.5mL 16mol·L-1浓硫酸与足量铜反应,转移电子数为0.2NA
C.7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA
D.0.5mol雄黄(As4S4,结构如右图)含有NA个S—S键
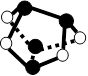
难度: 中等查看答案及解析
-
根据以下叙述制备氯化铜:先将浓盐酸用蒸气加热至80℃左右,慢慢加入含有FeO杂质的CuO粉,充分反应,使其溶解。已知:FeS不溶于水,但溶于酸。在除去溶液中的Fe2+时,可采用的方法是( )

A.可直接加碱,调整溶液的pH≥9.6
B.加入纯铜粉,将Fe2+还原为Fe
C.先将Fe2+氧化成Fe3+,再调整溶液pH至3~4
D.通入H2S使Fe2+直接沉淀
难度: 中等查看答案及解析
-
下列实验数据记录或实验方法正确的是( )
A.用天平称取4.0gNaOH固体,用100mL量筒配制1.00mol/L的NaOH溶液100mL
B.用25mL的滴定管(内装有标准NaOH溶液)滴定未知浓度的盐酸用去NaOH溶液15mL
C.用pH试纸测得新制氯水的pH为4
D.用250mL容量瓶配制250mL0.2mol/L的NaOH溶液
难度: 中等查看答案及解析
-
下列各组离子,在指定条件下,一定能大量共存的是( )
①某无色透明的酸性溶液中:Cl-、Na+、MnO4-、SO42-
②水电离产生的c(H+)=10-12mol/L的溶液中:K+、Ba2+、C1-、NO3-
③使紫色石蕊试液变红的溶液中:Fe2+、Mg+、NO3-、Cl-
④加入过量NaOH溶液后可得到澄清溶液:K+、Ba2+、HCO3-、Cl-
⑤c(H+)<c(OH-)的溶液中:C1O-、Cl-、K+、Na+
⑥在酸性高锰酸钾溶液中:Na+、NH4+、I-、ClO-
⑦能使pH试纸变深蓝色的溶液中:Na+、AlO2-、K+、CO32-
A.②⑤⑦ B.②③⑤⑦ C.①③④⑥⑦ D.②④⑤⑦
难度: 中等查看答案及解析
-
右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )

A.常压下五种元素的单质中Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
难度: 中等查看答案及解析
-
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合下图。则甲和X(要求甲和X能互换)不可能是( )
A.C和O2 B. SO2 和NaOH溶液
C.Cl2和Fe D.AlCl3溶液和NaOH溶液
难度: 中等查看答案及解析
-
有某硫酸和硝酸的混合溶液20mL,其中含有硫酸的浓度为2mol·L-1,含硝酸的浓度为1mol·L-1,现向其中加入0.96g铜粉,充分反应后(假设只生成NO气体),最多可收集到标准状况下的气体的体积为( )
A.224mL B.168mL C.112mL D.89.6mL
难度: 中等查看答案及解析
-
在1L含0.1 mol NaAlO2和0.1 mol Ba(OH)2的混合溶液中,逐滴加入浓度为0.1 mol·L-1的H2SO4溶液,所产生的沉淀的物质的量和所加入硫酸溶液的体积关系可用下列图像表示的是( )
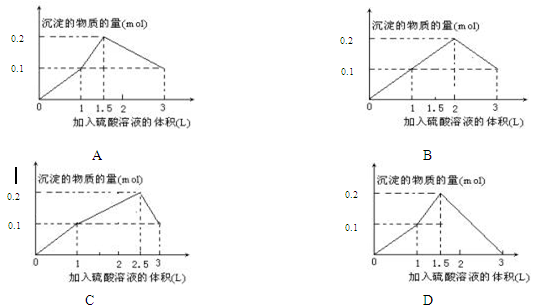
难度: 中等查看答案及解析
-
把Fe和Fe2O3组成的某混合物放入250mL2.0mol·L-1的HNO3溶液中,充分反应后,生成的NO气体在标准状况下的体积为1.12L,再向反应后的溶液中加入1.0mol·L-1的NaOH溶液,要使铁元素完全沉淀下来,所加入的NaOH溶液的体积最少是( )
A.400mL B.450mL C.500mL D.550mL
难度: 中等查看答案及解析
-
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色处理剂。工业是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4)。
湿法制备的主要反应方程式为: 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O
干法制备的主要反应方程式为: 2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列有关说法不正确的是( )
A.高铁酸钾中铁显+6价
B.湿法中每生成1 mol Na2FeO4转移3 mol电子
C.干法中每生成1 mol Na2FeO4转移4 mol电子
D.K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3还能吸附水中的悬浮杂质
难度: 中等查看答案及解析