-
下列物质的提纯方法可能属于化学变化的是
A.蒸馏 B.过滤 C.分液 D.洗气
难度: 中等查看答案及解析
-
如图所示,下列实验操作与方法正确的是

难度: 中等查看答案及解析
-
下列化学用语正确的是
A.硫的原子结构示意图:
 B.顺-2-丁烯的结构简式:
B.顺-2-丁烯的结构简式:
C.乙酸的实验式:C2H4O2 D.原子核内有8个中子的氧原子:188O
难度: 中等查看答案及解析
-
下列各组物质的分类正确的是
①混合物:氯水、氨水、水玻璃、水银、福尔马林、聚乙烯
②电解质:明矾、冰醋酸、石膏、纯碱
③非极性分子:CO2、CC14、CH2C12、对二甲苯
④同位素:1H+、2H2、3H
⑤同素异形体:C60、C80、金刚石、石墨
⑥同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
⑦同分异构体:乙二酸二乙酯、乙二酸乙二酯
A.②⑤ B.②④⑤⑦ C.②⑤⑥⑦ D.全部正确
难度: 中等查看答案及解析
-
下列说法不正确的是
A.区别溶液和胶体的方法是当一束光线通过胶体时可出现一条光亮的通路,溶液则没有此现象
B.将饱和FeCl3溶液滴入沸水中,继续加热煮沸至红褐色停止加热即得Fe(OH)3胶体
C.胶体带电荷,溶液不带电荷
D.土壤胶粒的比表面积巨大且一般带负电,能吸附NH等营养离子,使土壤具有保肥能力
难度: 中等查看答案及解析
-
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是
①向饱和碳酸钠溶液中通入过量的CO2 ②向Fe(OH)3胶体中逐滴加入过量的稀硫酸 ③向AgNO3溶液中逐滴加入过量氨水 ④向硅酸钠溶液中逐滴加入过量的盐酸
A.①② B.①③ C.①④ D.②③
难度: 中等查看答案及解析
-
下列实验操作或记录正确的是
A.常温常压下测得1 mol N2的质量为28 g
B.用量筒测得排水法收集制得的氢气体积为50.28 mL
C.用两个250 mL的容量瓶配制0.1 mol/L 500 mL的NaOH溶液
D.用托盘天平称得2.50 g胆矾,受热充分失水后,固体质量减轻0.90 g
难度: 中等查看答案及解析
-
为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的的是
A.Na2SO3溶液(BaCl2) B.FeCl2溶液(KSCN)
C.KI(淀粉溶液) D.NaOH溶液(盐酸)
难度: 中等查看答案及解析
-
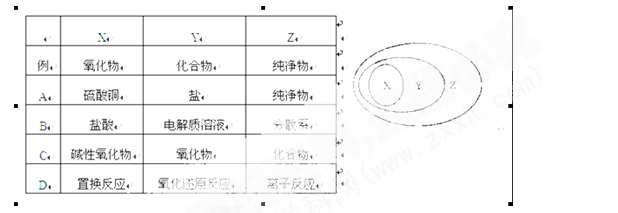
右图用交叉分类法表示了一些物质或概念之间的从属或包含关系,其中不正确的是
难度: 中等查看答案及解析
-
通常状况下,NCl3是一种油状液体,其分子空间构型与氨分子相似,下列对NC13的有关叙述正确的是
A.CCl4中C—C1键键长比NC13中N—C1键键长短
B.NCl3分子中四个原子共平面
C.分子中的所有原子均达到8电子稳定结构
D.NBr3比NCl3易挥发
难度: 中等查看答案及解析
-
在一定温度和压强下,1 L X气体和1 L Y气体完全反应后生成1 L水蒸气和1 L氮气。X、Y两种气体是
A.H2、N2O4 B.H2、N2O3
C.H2、N2O D.H2、NO2
难度: 中等查看答案及解析
-
在某无色透明的溶液中,能大量共存的离子组是
A.Na+ 、K+、SO42-、HCO3- B. Ba2+、K+、CO32-、NO3-
C.I-、 H+、Cl-、 NO3- D.Al3+、K+、SO42-、ClO-
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.少量SO2通入Ca(ClO) 2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3
+2HClO
B.氯化铁和铜反应:Fe3++Cu=Fe2++Cu2+
C.石灰水与碳酸氢钠溶液混合:Ca2++CO32-=CaCO3↓
D.硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数,下列叙述正确的是
A. 0.1 L 3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3NA
B.1mol金刚石中含有的共价键数目为4NA
C.1molNa2O2与足量的水反应,转移的电子数为2NA
D.分子数为NA的CO、N2的混合气体体积约为22.4L,质量为28g
难度: 中等查看答案及解析
-
将35g锌粉与少量浓硫酸在加热条件下充分反应,共收集到混合气体11.2L(标准状况),其质量为19.6g,则过剩的锌粉的质量为
A.1.0g B.2.0g C.2.5g D.3.5g
难度: 中等查看答案及解析
-
某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是

A.原溶液中一定含有SO42-离子 B.原溶液中一定含有NH4+离子
C.原溶液中一定含有Cl-离子 D.原溶液中一定含有Fe3+离子
难度: 中等查看答案及解析
-
在t℃时,将agNH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρg·cm—1,质量分数为ω,其中含NH4+的物质的量为b moL。下列叙述中正确的是
A.溶质的质量分数为ω=
B.溶质的物质的量浓度
C.溶液中c (OH—)=
D.上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
难度: 中等查看答案及解析
-
下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是

A.只有② B.①③ C.②④ D.①②③④
难度: 中等查看答案及解析
-
将40 mL 1.5 mol·L-1的CuSO4溶液与30 mL 3 mol·L-1的NaOH溶液混合生成浅蓝色沉淀,假如溶液中Cu2+或OH-浓度都已变得很小,可忽略,则生成沉淀的组成可表示为
A.Cu(OH)2 B.CuSO4·Cu(OH)2
C.CuSO4·2Cu(OH)2 D.CuSO4·3Cu(OH)2
难度: 中等查看答案及解析
-
固体单质A和气体单质B在容积一定的密闭容器中完全反应生成气体C,同温下测得容器内压强不变,且反应后气体C的密度是原气体密度的4倍。则下列判断正确的是
A.生成的气体C为单质,且B和C的摩尔质量比为1∶4
B.生成物C中A的质量分数为75%
C.生成物C中A、B的原子个数比为3∶1
D.反应前后气体分子数比为1∶4
难度: 中等查看答案及解析