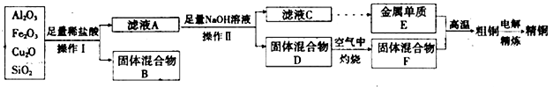
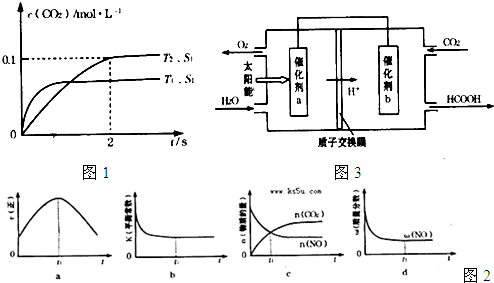
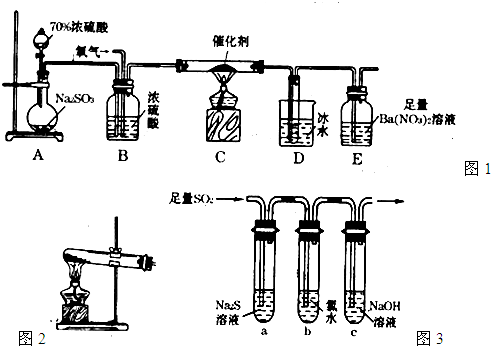
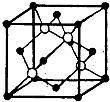
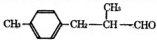
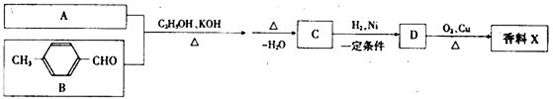
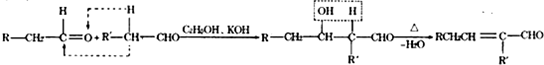-
化学与社会、环境密切相关,下列有关说法正确的是( )
A.绿色化学的核心是应用化学原理对环境污染进行治理
B.氯气和氢氧化钠溶液或石灰乳反应得到的含氯化合物都具有漂白性
C.高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
D.蒸馏“地沟油”可以获得汽油难度: 中等查看答案及解析
-
下列关于有机化合物的性质说法正确的是( )
A.棉花和蛋白质都是高分子化合物,水解产物相同
B.苯和乙烯都能使溴水褪色,均与溴水发生加成反应
C.乙酸乙酯和油脂互为同系物
D.甲烷和乙醇均能发生取代反应难度: 中等查看答案及解析
-
下列有关说法错误的是( )
A.通过化学反应无法生成新的同位素
B.若化学平衡向正反应方向移动,则正反应速率一定增大
C.盐酸、氢氧化铁胶体、汽油、橡胶均为混合物
D.生成盐和水的反应不一定是中和反应难度: 中等查看答案及解析
-
下列操作或仪器的选用正确的是( )
A. 实验室制备氨气
实验室制备氨气
B.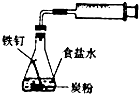 铁的析氢腐蚀
铁的析氢腐蚀
C.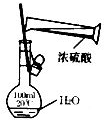 配置稀硫酸溶液
配置稀硫酸溶液
D.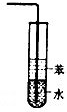 氯化氢的尾气吸收
氯化氢的尾气吸收 难度: 中等查看答案及解析
-
下列有关实验基本操作的说法错误的是( )
A.存放浓硝酸时,使用带玻璃塞的棕色玻璃瓶
B.酸碱中和滴定时,若未用待测液润洗锥形瓶,对测定结果无影响
C.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗上口倒出
D.将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀难度: 中等查看答案及解析
-
下列对有关物质性质的分析正确的是( )
A.Na久置于空气中,可以和空气中的有关物质反应,最终生成NaHCO3
B.在高温下用氢气还原MgCl2可制取金属镁
C.实验测得NH4HCO3溶液显碱性,CH3COONH4溶液显中性,说明酸性CH3COOH>H2CO3
D.N2的化学性质通常非常稳定,但在放电条件下可以与O2应生成NO2难度: 中等查看答案及解析
-
下列有关物质的性质或结构的说法正确的是( )
A.L层上的电子数为奇数的原子一定是主族元素的原子
B.周期表中的碱金属元素从上到下,其单质的还原性逐渐增强,熔沸点逐渐升高
C.化学键的形成一定伴随着电子的转移和能量变化
D.元素周期表中,位于金属和非金属分界线附近的元素属于过渡元素难度: 中等查看答案及解析
-
如图是某煤发电厂处理废气的装置示意图.下列说法错误的是( )
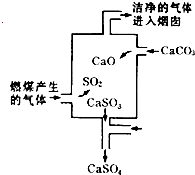
A.使用此废气处理装置可减少酸雨的形成
B.装置内发生的反应有化合、分解、置换和氧化还原反应
C.整个过程的反应可表示为:2SO2+2CaCO3+O2═2CaSO4+2CO2
D.可用酸性高锰酸钾溶液检验废气处理是否达标难度: 中等查看答案及解析
-
室温时,下列各组离子在指定溶液中可以大量共存的是( )
A.由水电离出的c(H+)=10-12mol/L的溶液中:Na+、Ba2+、HCO、C1-
B.无色透明溶液中:K+、Cu2+、SO、Na+
C.含有大量AlO2-的溶液中:Na+、OH-、Cl-、CO
D.能使pH试纸显红色的溶液中:Na+、ClO-、Fe2+、SO难度: 中等查看答案及解析
-
下列说法正确的是(设NA表示阿伏加德罗常数的值)( )
A.80℃时,1L pH=1的硫酸溶液中,含有0.2NA个H+
B.4.6g Na完全转化成Na2O和Na2O2的混合物,生成物中阴离子总数为0.1 NA
C.标准状况下,2.24L Cl2溶于水,转移的电子数目为0.1NA
D.300mL 2mol/L蔗糖溶液中所含分子数为0.6NA难度: 中等查看答案及解析
-
反应A(g)+B(g)→C(g)△H,分两步进行:①A(g)+B(g)→X(g)△H1 ②X(g)→C(g)△H2,反应过程中能量变化如图所示,E1表示A+B→X的活化能,下列说法正确的是( )
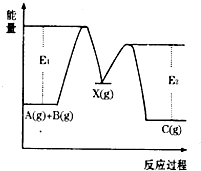
A.△Hl=△H-△AH2>0
B.X是反应A(g)+B(g)→C(g)的催化剂
C.E2是反应②的活化能
D.△H=E1-E2难度: 中等查看答案及解析
-
无水氯化铝是一种重要韵催化剂,工业上由Al2O3制备无水氯化铝的反应为:2Al2O3(s)+6Cl2(g)
4AlCl3(g)+3O2(g)△H>0.下列分析错误的是( )
A.增大反应体系的压强,反应速率可能加快
B.加入碳粉,平衡向右移动,原因是碳与O2反应,降低了生成物的浓度且放出热量
C.电解熔融的Al2O3和AlCl3溶液均能得到单质铝
D.将AlCl3•6H2O在氯化氢气流中加热,也可制得无水氯化铝难度: 中等查看答案及解析
-
有关如图装置的叙述中,正确的是( )
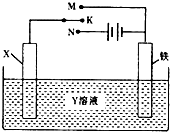
A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为外接电源的阴极保护法
B.若X为碳棒,Y为饱和NaOH溶液,开关K置于N处,保持温度不变,则溶液的pH保持不变
C.若X为银棒,Y为硝酸银溶液,开关K置于N处,铁棒质量将增加,溶液中银离子浓度将减小
D.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铁电极移动难度: 中等查看答案及解析
-
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的PH变化曲线如图所示,下列判断正确的是( )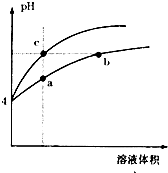
A.a、c两点溶液的导电能力相同
B.b点溶液中c(H+)+c=c(OH-)
C.用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb=V
D.a、b、c三点溶液水的电离程度a>b>c难度: 中等查看答案及解析