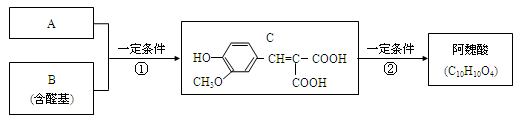
-
下列叙述正确的是( )
A.明矾和ClO2常用于自来水的净化和杀菌消毒,两者的反应原理相同。
B.盛放KOH溶液的试剂瓶不能用橡胶塞,应该用玻璃塞。
C.北京时间3月11日日本发生9.0级地震,引起核泄漏,产生的粉尘中含有较多的131I,这是一种质子数为131的有放射性的碘的一种核素。
D.冰岛和印度尼西亚火山喷发,火山灰在空气中几周都不能沉降,可能与胶体的性质有关。
难度: 中等查看答案及解析
-
在一定条件下,等物质的量的氯气与碘单质反应,得到一种红棕色液体ICl,ICl有很强的氧化性。现有下列两个反应:①2ICl+2Zn==ZnCl2+ZnI2 ②ICl+H2O===HCl+HIO。下列叙述正确的是( )
A.C12与I2生成ICl是非氧化还原反应
B.反应①中,ZnI2只是氧化产物
C.反应①中,当转移0.4mol电子时生成13.6g ZnCl2
D.反应②中,ICl既是氧化剂又是还原剂
难度: 中等查看答案及解析
-
右图是酷似奥林匹克旗中五环的一种有机物,被称之为奥林匹克烃,下列说法正确的是( )

A.该有机物属于苯的同系物
B.该有机物的一氯代物有一种
C.该有机物属于苯的衍生物
D.该有机物完全燃烧生成H2O 的物质的量小于CO2的物质的量
难度: 中等查看答案及解析
-
200℃时,11.6 g CO2和H2O的混合物气体与足量的Na2O2反应,反应后固体增加了3.6 g,则原混合物的平均相对分子质量为( )
A.5.8 B.11.6 C.23.2 D.46.4
难度: 中等查看答案及解析
-
关于下列装置说法正确的是( )
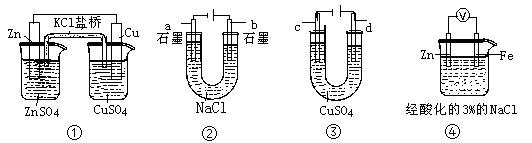
A.装置①中,盐桥中的Cl-移向ZnSO4溶液
B.装置②工作一段时间后,b极附近溶液的pH增大
C.用装置③精炼铜时,c极为粗铜
D.装置④中电子由Zn流向Fe,装置中有Fe2+生成
难度: 中等查看答案及解析
-
25 ℃时,在25 mL 0.1 mol·L-1的NaOH溶液中,逐滴加入0.2 mol·L-1的CH3COOH溶液,溶液的pH与醋酸体积关系如图所示,下列分析正确的是
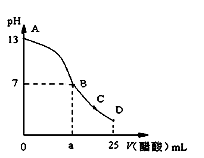
A.B点的横坐标a=12.5
B.D点时溶液中有:C(CH3COO-)+C (CH3COOH)=2 C (Na+)
C.C点时溶液中有:C (Na+)> C (CH3COO-) > C (H+)> C (OH-)
D.曲线上A、B间的任意一点,溶液中都有:C(CH3COO-)> C (Na+)> C(OH-)> C(H+)
难度: 中等查看答案及解析
-
下列各表述与示意图一致的是( )

若图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。
A.图①三种离子的物质的量之比为: n(Mg2+):n(Al3+):n(NH4+)=2:3:2
B.图①中使用的NaOH的浓度为2mol/L
C.图②中曲线表示某反应过程的能量变化。 若使用催化剂,B点会降低
D.图②中物质A反应生成物质C,△H>0;
难度: 中等查看答案及解析
-
下列各表述与示意图一致的是( )

若图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。
A.图①三种离子的物质的量之比为: n(Mg2+):n(Al3+):n(NH4+)=2:3:2
B.图①中使用的NaOH的浓度为2mol/L
C.图②中曲线表示某反应过程的能量变化。 若使用催化剂,B点会降低
D.图②中物质A反应生成物质C,△H>0;
难度: 中等查看答案及解析