-
2010年诺贝尔物理学奖授予英国曼彻斯特大学的两位科学家,以表彰他们在石墨烯材料方面的卓越研究。石墨烯是由石墨剥离而成,其是由碳原子构成的单层片状结构的新材料(结构如图),性质稳定导电性好,有望代替硅可能引发电子工业革命。下列说法中正确的( )
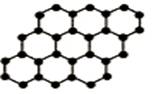
A.石墨烯与石墨互为同位素
B.0.12g石墨烯中含有6.02×1022个碳原子
C.石墨烯是一种有机物
D.石墨烯中的碳原子间以共价键相结合
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA
B.标准状况下,22.4L己烷中共价键的数目为19NA
C.由CO2和O2组成的混合物中共有NA个分子,则其中的氧原子数为2NA
D.1L浓度为1mol·L-1的Na2CO3溶液中含有NA个CO32-
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.任何化学反应都伴随着能量的变化
B.1 mol H2SO4和 1 mol Ba(OH)2完全反应所放出的热量称为中和热
C.在101kPa 时,1 mol 碳燃烧放出的热量就是碳的燃烧热
D.在化学反应中需要加热的反应就是吸热反应
难度: 简单查看答案及解析
-
某短周期元素的最高价氧化物所对应的水化物的化学式为HxROy,气态氢化物的化学式为HzR(或RHz)。已知1molHxROy比1molHzR质量多64g,下列说法不正确的是( )
A.2y-x+z=8 B.y=4
C.R一定是硫元素 D.R一定处于第三周期
难度: 简单查看答案及解析
-
小明做实验时不小心沾了一些KMnO4,皮肤上的黑斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:MnO4-+H2C2O4+H+→CO2↑+Mn2++□(未配平)。关于此反应的叙述正确的是( )
A.该反应的氧化剂是H2C2O4 B.1molMnO4-在反应中失去5mol电子
C.该反应右框内的产物是OH- D.配平该反应后,H+的计量数是6
难度: 简单查看答案及解析
-
下列实验数据记录正确的是( )
A.用天平称取4.0g NaOH固体,用100ml量筒配制1.0000 mol/L的NaOH溶液
B.用25mL的滴定管(内装有标准碱液)滴定未知浓度的酸用去碱液22.32mL
C.用pH试纸测得新制氯水的pH为4
D.常温下,由收集的500mLNO2气体求得NO2气体的物质的量为(0.5/22.4) mol
难度: 简单查看答案及解析
-
在盛有1mL1mol·L-1AlCl3溶液的试管中加入2 mL10%的NH4F溶液,再加入1mL3mol·L-1氨水,没有生成白色沉淀,其原因是( )
A.溶液的碱性不够强 B.Al3+不与氨水反应
C.生成的Al(OH)3溶解了 D.Al3+几乎都与F-结合生成了新的物质
难度: 简单查看答案及解析
-
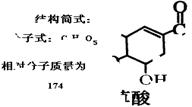
咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为
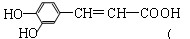 下列有关咖啡酸的说法中,不正确的是( )
下列有关咖啡酸的说法中,不正确的是( )A.咖啡酸分子中的所有碳原子可能共平面
B.咖啡酸可以发生还原、酯化、加聚、显色等反应
C.1 mol咖啡酸可与4 mol Br2发生反应
D.1 mol咖啡酸与NaOH溶液反应最多消耗1 mol的NaOH
难度: 简单查看答案及解析
-
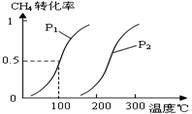
对于可逆反应N2(g)+3H2(g)
2NH3(g);△H<0,下列研究目的和示意图相符的是( )
A
B
C
D
研究
目的
压强对反应的影响(P2>P1)
温度对反应的影响
平衡体系增加N2的浓度 对反应的影响
催化剂对反应的影响
图示

难度: 简单查看答案及解析
-
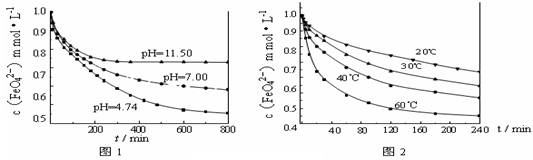
下列说法正确的是( )
A.根据Ksp(AgCl)=1.77×10-10,Ksp(Ag2CrO4)=1.12×10-12,可以推知AgCl的溶解度比Ag2CrO4的溶解度大
B.0.1mol·L-1的ZnCl2溶液中通入足量硫化氢气体,最终得不到ZnS沉淀。是因为溶液中c(Zn2+)·c(S2-)<Ksp(ZnS)
C.向硫酸钡沉淀中加入碳酸钠溶液,沉淀发生转化,据此可推知碳酸钡的Ksp比硫酸钡的小
D.AgCl在10mL 0.01mol·L-1的KCl溶液中比在20mL0.05mol·L-1的AgNO3溶液中溶解的质量少
难度: 简单查看答案及解析
-
下列实验操作或结论表述正确的是 ( )
A.纸层析实验中若选择水做固定相,有机溶剂做流动相,则亲水性强的成分在流动相中分配的少一些,在毛细现象作用下,随流动相移动的速度快一些
B.判断CuO和MnO2对H2O2分解的催化效率,可通过观察比较H2O2溶液析出气泡的快慢程度,或测定单位时间内H2O2分解产生氧气的体积
C.食醋总酸含量测定实验中,锥形瓶水洗后未用待测液润洗,实验结束时碱式滴定管尖嘴部位有气泡,则测定的醋酸含量偏高
D.将硫酸亚铁和硫酸铵的混合溶液加热浓缩,冷却结晶后可析出摩尔盐粗产品,再用酒精洗去晶体表面的水分,加热烘干后称重,计算产率
难度: 简单查看答案及解析
-
在指定环境中,下列各组离子一定可以大量共存的是( )
A.使pH试纸呈红色的溶液:
、
、
、
B.常温下,在
的溶液:
、
、
、
C.加入铝粉放出氢气的溶液:
、
、
、
D.使无色酚酞试液显红色的溶液:
、
、
、
难度: 简单查看答案及解析
-
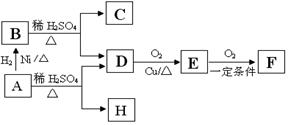
如图M、N为含X元素的常见化合物,则X元素为: ( )

A.Cu或Fe B.N或S[
C.Fe或C D.C或Al
难度: 简单查看答案及解析
-
已知一定温度和压强下,合成氨反应:N2(g)+3H2(g)
2NH3(g) △H=-92.0KJ·mol-1,将1mol N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为20%。若在相同条件下,起始时在该容器中充入2mol NH3,反应达到平衡时的热量变化是( )
A.吸收18.4KJ热量 B.放出73.6KJ热量
C.放出18.4KJ热量 D.吸收73.6KJ热量
难度: 简单查看答案及解析
-
下列曲线图与对应选项不正确的是 ( )

A.向1L浓度均为0.1mol·L-1的Ba(OH)2、NaAlO2混合液中逐滴加入0.1 mol·L-1稀H2SO4溶液
B.向含有0.1 mol·L-1 AlCl3和0.3mol/L NH4Cl的1L混合液中逐滴加入0.1mol·L-1NaOH溶液:]
C.向烧碱溶液中逐滴加入明矾溶液
D.向Ba(OH)2溶液中逐渐通入二氧化碳气体
难度: 简单查看答案及解析
-
已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,下列说法正确的是( )
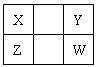
A.Z元素的原子半径可能比Y元素的小
B.Z元素的最高化合价可能比Y元素的高
C.W的气态氢化物的稳定性一定比Y的强
D.Z的最高价氧化物的水化物的酸性一定比W的强
难度: 简单查看答案及解析
-
某同学设计如下实验测量m g铜银合金样品中铜的质量分数:
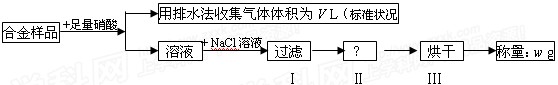
下列说法中不正确的是( )
A.收集到的V L气体全为 NO
B.过滤用到的玻璃仪器是:烧杯、漏斗、玻璃棒
C.操作Ⅱ应是洗涤
D.铜的质量分数为:
×100%
难度: 简单查看答案及解析
-
某溶液中只含有Na+、H+、OH-、A-四种离子,下列说法正确的是( )
A.若c(OH-)>c(H+),溶液中不可能存在:c(Na+)>c(OH-)>c(A-)>c(H+)
B.溶液中不可能存在:c(Na+)>c (A-)>c(OH-)>c(H+)
C.若溶液中c(A-) = c(Na+),则溶液一定呈中性
D.若溶质为NaA、HA,则一定存在: c(A-)>c(Na+)>c(H+)>c(OH-)
难度: 简单查看答案及解析
-
下列操作或仪器的选用正确的是 ( )

难度: 简单查看答案及解析
-
下列离子方程式书写正确的是( )
A.溴乙烷与6mol/L的氢氧化钠水溶液共热:C2H5Br+OH-
CH2=CH2↑+Br-+H2O
B.等物质的量浓度、等体积的Ca(HCO3)2溶液与氢氧化钠溶液相混合:
Ca2++2HCO3-+2OH-
CaCO3↓+CO32-+2H2O[
C.在含有等物质的量的Fe(NO3)2和KI组成的混合溶液中滴入1~2滴盐酸:
3Fe2++4H++NO3-
3Fe3++NO↑+2H2O
D.在H2O2中加入酸性高锰酸钾溶液:2MnO4-+6H++5H2O2
2Mn2++5O2↑+8H2O
难度: 简单查看答案及解析
-
在t℃下,某反应达到平衡,平衡常数K=
。恒容时,温度升高,NO浓度减小。下列说法正确的是( )
A.该反应的焓变为正值
B.K表达式中,C(SO3)指反应在该条件下达到化学平衡时SO3的物质的量浓度
C.升高温度,逆反应速率减小
D.该反应化学方程式为:NO+SO3
NO2+SO2
难度: 简单查看答案及解析
-
当向蓝色的CuSO4溶液中逐滴加入氨水时,观察到首先生成蓝色沉淀,而后沉淀又逐渐溶解成为深蓝色的溶液,向深蓝色溶液中通入SO2气体,又生成了白色沉淀:将白色沉淀加入稀硫酸中,又生成了红色粉末状固体和SO2气体,同时溶液呈蓝色,根据上述实验现象分析推测,下列描述正确的是( )
A.Cu2+和Ag+相似,能与NH3结合生成铜氨络离子
B.白色沉淀为+2价铜的某种亚硫酸盐,溶于H2SO4发生复分解反应
C.白色沉淀为+1价铜的某种亚硫酸盐,在酸性条件下,Cu+只被氧化
D.反应过程中消耗的SO2与生成的SO2的物质的量相等
难度: 简单查看答案及解析
-
锂电池用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(SOCl2)中形成的,该电池的总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S,下列叙述中正确的是( )
A.电解质溶液中混入水,对电池反应无影响
B.上述过程中是电能转化成化学能
C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D.电池工作过程中,金属锂提供电子的物质的量与析出硫的物质的量之比为4 :1
难度: 简单查看答案及解析
-
1840年,俄国化学家盖斯(G·H·Hess)从大量的实验事实中总结出了一条规律:化学反应不管是一步完成还是分几步完成,其反应热是相同的,即盖斯定律。盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知每摩单质碳完全燃烧生成CO2放出热量为Y kJ,则1mol C与O2反应生成CO的反应热△H为( )
A.-Y kJ/mol B.-(10X-Y) kJ/mol
C.-(5X-0.5Y) kJ/mol D.+(10X-Y) kJ/mol
难度: 简单查看答案及解析
-
在200 mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。下列叙述正确的是( )
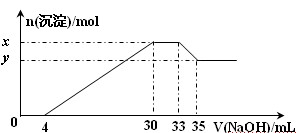
A.x与y的差值为0.1 mol
B.原溶液中c(Cl-)=0.75 mol·L-1
C.原溶液的pH=1
D.原溶液中n(Mg2+)∶n(Al3+)=5∶2
难度: 简单查看答案及解析