-
化学与科学、技术、社会、环境密切相关,下列说法中正确的是
A.钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水
B.废弃的塑料、金属、纸制品及玻璃都是可回收再利用的资源
C.凡含有食品添加剂的食物对人体健康均有害,不宜食用
D.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油”
难度: 简单查看答案及解析
-
下列化学用语正确的是
A.CO2的比例模型
B.H2O2的电子式
C.氨分子的结构式
D.14C的原子结构示意图
难度: 简单查看答案及解析
-
下列做法存在安全隐患的是
①将水沿烧杯内壁缓缓加入浓硫酸中,用玻璃棒不断搅拌
②实验室制取氯气时,尾气用碱液吸收
③取用金属钠或钾做完实验后,剩余的药品要放回原瓶
④夜间厨房发生煤气泄漏时,应立即开灯检查煤气泄漏的原因,然后打开所有的门窗通风
⑤干冰可用于钠、镁等金属的灭火
A.①④⑤ B.①②③④ C.①③④⑤ D.全部
难度: 简单查看答案及解析
-
家庭住宅的窗玻璃大部分是普通玻璃,其成分是Na2SiO3·CaSiO3·6SiO2,在生产过程中加入不同的物质,调整玻璃的化学成分,可以制得具有不同性能和用途的玻璃。下表所列不正确的是
选项
A
B
C
D
添加成分
Co2O3(氧化钴)
Cu2O
Fe2+
PbO
玻璃的色彩或性能
蓝色
红色
钢化玻璃
光学玻璃
难度: 简单查看答案及解析
-
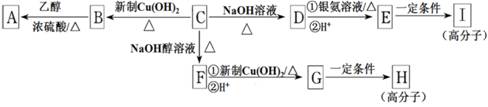
医药中,常用酒精来消毒,是因为酒精能够
A.使细菌蛋白体发生盐析 B.使细菌蛋白体发生变性
C.与细菌蛋白质发生氧化反应 D.与细菌配合体生成配合物
难度: 简单查看答案及解析
-
化石燃料是不可再生的,最终将会枯竭。基于我国目前的技术水平和管理水平,能源从开采、运输、加工到终端的利用效率都很低,浪费很大。据统计,开采效率为32%,加工运输效率为70%,终端利用率为41%,则总效率近似为
A.1.43% B.14.3% C.9.18% D.91.8%
难度: 简单查看答案及解析
-
下列说法正确的是
A.C6H5CH2OH不属于醇类
B.油脂的硬化属于水解反应
C.苯和甲苯都能使KMnO4酸性溶液褪色
D.1-氯丙烷和2-氯丙烷分别与NaOH乙醇溶液共热的反应产物相同
难度: 简单查看答案及解析
-
为提纯下列物质(括号中为杂质),所选除杂试剂和分离方法都正确的是
选项
被提纯的物质(杂质)
除杂试剂
分离方法
A
NH3(H2O)
浓硫酸
洗气
B
苯(苯酚)
浓溴水
过滤
C
溴化钠溶液(NaI)
氯水、CCl4
萃取、分液
D
乙醇(水)
生石灰
蒸馏
难度: 简单查看答案及解析
-
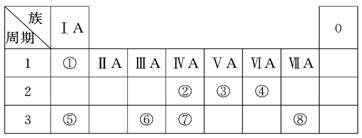
元素X、Y、Z原子序数之和为36,X、Y在同一周期,X2+与Z2-具有相同的核外电子层结构。下列推测正确的是
A.同族元素中Z的氢化物稳定性最高
B.原子半径X>Y,离子半径X2+>Z2-
C.同主族元素中X的金属性最弱
D.同周期元素中Y的最高价含氧酸的酸性最强
难度: 简单查看答案及解析
-
由短周期的两种元素组成的化合物XY3,下列说法错误的是
A.X可能是金属,也可能是非金属
B.X和Y位于同一周期时,只能形成一种物质
C.X和Y可能位于同一主族,也可能位于不同主族
D.化合物XY3溶于水,溶液可能显碱性,也可能显酸性
难度: 简单查看答案及解析
-
某工厂生产的某产品只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等)。下列物质中与该产品互为同分异构体的是
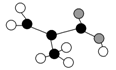
A.CH2===C(CH3)COOH
B.CH2===CHCOOCH3
C.CH3CH2CH===CHCOOH
D.CH3CH(CH3)COOH
难度: 简单查看答案及解析
-
若NA表示阿伏加德罗常数,下列说法正确的是
A.NA个N2分子的质量与CO的摩尔质量完全相同
B.常温常压下,1mol氦气含有的核外电子数为2NA
C.50g 98%的浓硫酸中,所含的氧原子数为2NA
D.28.6gNa2CO3·10H2O晶体完全溶于水中,溶液中含CO32-的数目为0.1 NA
难度: 简单查看答案及解析
-
下列各组离子在指定的溶液中,能大量共存的是
①酸性溶液中:Fe2+、Al3+、NO3-、Cl-、I-
②pH=13的溶液:Na+、CO32-、SO32-、AlO2-、S2-
③水电离出来的c(H+)=10—13mol/L的溶液:NH4+、K+、NO3-、S2O32-
④加入铝片能放出H2的溶液:Na+、HCO3-、Cu2+、SO42-
⑤滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、NO3-
A.①② B.②③ C.②④⑤ D.②⑤
难度: 简单查看答案及解析
-
科学家对人造血液和人造器官的研制及应用已取得了很大的进步。以下物质可以作为人工心脏、人工血管等人造器官的高分子生物材料:
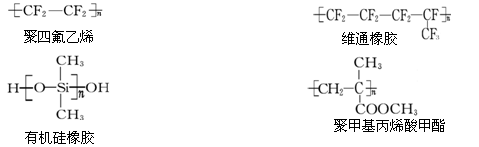
下列关于上述高分子生物材料的说法中正确的是
A.用于合成维通橡胶的单体是
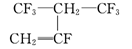
B.用于合成有机硅橡胶的单体是
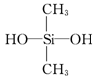
C.聚四氟乙烯、有机硅橡胶均可看做加聚反应的产物
D.有机硅橡胶、聚甲基丙烯酸甲酯均可通过缩聚反应制得
难度: 简单查看答案及解析
-
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是
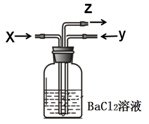
A.洗气瓶中产生的沉淀是碳酸钡
B.在Z导管出来的气体中无二氧化碳
C.洗气瓶中产生的沉淀是亚硫酸钡和碳酸钡
D.在Z导管的出口处会有红棕色气体出现
难度: 简单查看答案及解析
-
化学工业在经济发展中的作用举足轻重,下列有关工业生产的叙述中正确的是
A.氯碱工业中阳极得到氢氧化钠和氢气
B.电镀铜时,电镀液中c(Cu2+)基本保持不变
C.合成氨中采取及时分离液态氨来提高反应速率
D.海水中含有钾元素,只需经过物理变化就可以得到钾单质
难度: 简单查看答案及解析
-
下列化学用语书写正确的是
A.NaHS水解反应:HS-+ H2O
H3O++ S2-
B.明矾加入在水中起净化作用的原因:
Al3+ + 3H2O=Al(OH)3(胶体) + 3H+
C.已知: 2Zn(s)+O2(g)=2ZnO(s);△H=-701.0kJ·mol-1
2Hg(l)+O2(g)=2HgO(s);△H=-181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l);△H=-259.7kJ·mol-1
D.碳酸氢钠溶液中加入过量Ba(OH)2溶液:
2HCO3- + Ba2+ + 2OH- = BaCO3↓+ CO32-+ 2H2O
难度: 简单查看答案及解析
-
将pH=3的盐酸a L分别与下列三种溶液混合,混合后溶液均呈中性,其中a、b、c、d的关系正确的是
①1×10-3 mol·L-1的氨水b L
②c(OH-)=1×10-3 mol·L-1的氨水c L
③c(OH-)=1×10-3 mol·L-1的Ba(OH)2溶液d L
A.b>a=d>c B.a=b>c>d
C.a=b>d>c D.c>a=d>b
难度: 简单查看答案及解析
-
根据表中信息,判断下列叙述中正确的是
序号
氧化剂
还原剂
其他反应物
氧化产物
还原产物
①
Cl2
FeBr2
/
Cl-
②
KClO3
浓盐酸
/
Cl2
③
KMnO4
H2O2
H2SO4
O2
Mn2+
A.表中①组的反应可能有一种或两种元素被氧化
B.氧化性强弱的比较: KClO3>Fe3+>Cl2>Br2
C.表中②组反应的还原产物是KCl,电子转移数目是6e-
D.表中③组反应的离子方程式为:2MnO4-+ 3H2O2 + 6H+=2Mn2+ + 4O2↑+ 6H2O
难度: 简单查看答案及解析
-
两种一元碱MOH和ROH的溶液分别加水稀释,溶液pH的变化如图所示,下列叙述不正确的是

A.MOH是一种弱碱
B.在x点,c(M+)=c(R+)
C.稀释前,c(ROH)=10 c(MOH)
D.稀释前MOH溶液和ROH溶液中由水电离出的c(OH-)前者是后者的 10倍
难度: 简单查看答案及解析