-
根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
实验结论
A
向苯酚浊液中加入Na2CO3溶液,溶液变澄清
酸性:苯酚>HCO3-
B
将少量Fe(NO3)2加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液,溶液变成血红色
Fe(NO3)2已变质
C
氯乙烷与NaOH溶液共热后,滴加AgNO3溶液,生成白色沉淀
氯乙烷发生水解
D
在2 mL 0.01 mol·L-1的Na2S溶液中先滴入几滴0.01 mol·L-1 ZnSO4溶液有白色沉淀生成,再滴入0.01 mol·L-1 CuSO4溶液,又出现黑色沉淀
Ksp(CuS)<Ksp(ZnS)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
化学与生活,社会发展息息相关、下列有关说法不正确的是
A. “霾尘积聚难见路人”。雾霾所形成的气溶胶有丁达尔效应
B. “曾青(硫酸铜)涂铁,铁赤色如铜”过程中发生了置换反应
C. 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶
D. 医用酒精体积分数是75%,用医用酒精菌消毒是使细菌、病毒蛋白质变性后死亡
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 在标准状况下.11.2L丙烷含有的极性键数目为5NA
B. 7g锂在空气中完全燃烧时转移的电子数为NA
C. 1mol葡萄糖(C6H12O6)分子含有的羟基数目为6NA
D. 常温下,0.2L0.5mol/LNH4NO3溶液中含有的氮原子数小于0.2NA
难度: 中等查看答案及解析
-
工业酸性废水中的Cr2O72-可转化为Cr3+除去,实验室用电解法模拟该过程,结果如下表所示(实验开始时溶液的体积均为50mL,Cr2O72-的起始浓度、电压、电解时间均相同)。下列说法中,不正确的是
实验
①
②
③
电解条件
阴、阳极均
为石墨
阴、阳极均为石墨,滴
加1mL浓硫酸
阴极为石墨,阳极为铁,
滴加1mL浓硫酸
Cr2O72-的去除率/%
0.922
12.7
57.3
A. 对比实验①②可知,降低pH可以提高Cr2O72-的去除率
B. 实验③中,理论上电路中每通过6mol电子,就有1molCr2O72-被还原
C. 实验②中,Cr2O72-在阴极放电的电极反应式是Cr2O72-+6e-+14H+=2Cr3++7H2O
D. 实验③中,C2O72-去除率提高的原因是Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
难度: 困难查看答案及解析
-
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是

A.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
B.滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
C.该分子中的所有碳原子不可能共平面
D.1mol此物质分别与浓溴水和H2反应时最多消耗Br2和H2为4mol和7mol
难度: 困难查看答案及解析
-
短周期主族元素A、B、C、D的原子序数依次增大。已知A、C的原子序数之差为8,A、B、C三种元素原子的最外层电子数之和为15,B元素原子的最外层电子数等于A元素原子的最外层电子数的一半,下列叙述正确的是
A. 简单离子的半径:B>C>D>A
B. B与C形成的化合物在水溶液中能稳定存在
C. C与D都可形成具有漂白性的化合物,且漂白原理相同
D. B与D形成的化合物溶于水所得溶液显酸性
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是( )
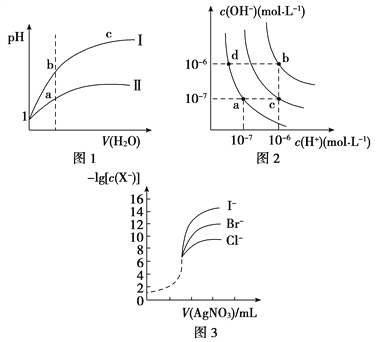
A. 图1表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B. 图2中纯水仅升高温度,就可以从a点变到c点
C. 图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性
D. 用0.010 0 mol/L硝酸银标准溶液,滴定浓度均为0.100 0 mol/L Cl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl-
难度: 困难查看答案及解析
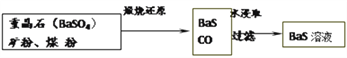
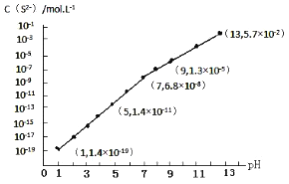
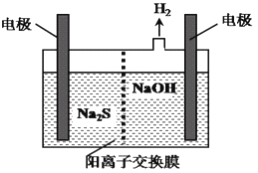
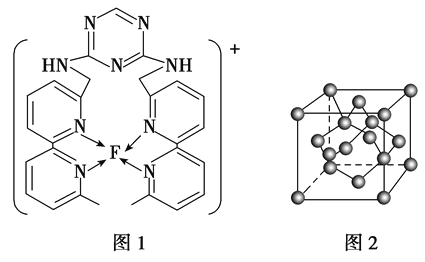
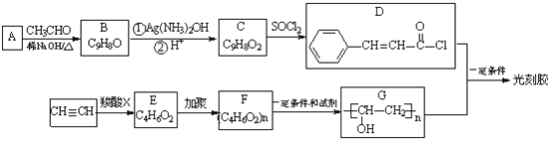
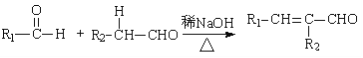 (R,R’为烃基或氢)
(R,R’为烃基或氢)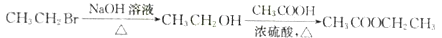 _______________________
_______________________