-
下列有关环境问题的说法不正确的是( )
A.燃煤时加入适量石灰石,可减少废气中SO2的含量
B.京津冀、长三角、珠三角雾霾的形成与煤的燃烧、化工厂大量排放含硫、含氮氧化物、颗粒物和汽车排放的尾气等有关
C.pH小于7.0的降雨通常称为酸雨
D.使用洁净能源、为汽车安装尾气转化装置、对硝酸厂排放的废气进行碱处理能有效控制氮氧化物对空气的污染
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.大量燃烧化石燃料是造成雾霾的一种重要因素
B.食品中的抗氧化剂本身是难于氧化的物质
C.含SO42﹣的澄清溶液中不会含Ba2+
D.凡溶于水能电离出H+离子的化合物均属于酸
难度: 简单查看答案及解析
-
化学与生活息息相关,下列说法正确的是( )
A.我国居民传统膳食以糖类为主,淀粉、脂肪都是糖类物质
B.人体内的蛋白质不断分解,最终生成水和二氧化碳排出体外
C.长期烧水的水壶内壁容易形成一层水垢,可以用食醋除去
D.明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用
难度: 中等查看答案及解析
-
下列物质性质和应用的对应关系正确的是( )
A.84消毒液具有碱性,可用作消毒剂和漂白剂
B.氢氟酸具有酸性,可用于玻璃的腐蚀剂
C.过氧化钠具有漂白性,可作航空和潜水的供氧剂
D.活性铁粉具有还原性,在食品袋中可用作除氧剂
难度: 简单查看答案及解析
-
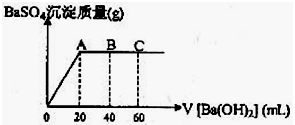
只用一种试剂可区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液,这种试剂是( )
A.NaOH B.H2SO4 C.BaCl2 D.AgNO3
难度: 简单查看答案及解析
-
下列气体,溶于水后可以生成两种酸的是( )
A.SO2 B.CO2 C.Cl2 D.NH3
难度: 简单查看答案及解析
-
(不定项)下列除去杂质(括号内为杂质)的方法中,正确的是( )
A.乙烷(乙炔):将混合气体通过酸性高锰酸钾溶液,洗气除去乙烷中的乙炔气体
B.苯(苯酚):向混合液中加入适量的浓溴水,过滤,除去苯中的少量苯酚
C.酒精(水):向含水酒精中加入生石灰,蒸馏,得到无水酒精
D.硝基苯(NO2):向溶有杂质的硝基苯加入一定量的浓氢氧化钠溶液,振荡,分液可除去中溶解的NO2
难度: 中等查看答案及解析
-
已知甲醛分子中的4个原子在同一平面上,下列分子中的所有原子不可能同时存在于同一平面上的是( )
A.
 B.
B.
C.
 D.
D.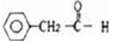
难度: 中等查看答案及解析
-
下列叙述中,正确的是( )
A.醛和酮是不同类的同分异构体,二者的化学性质相似
B.能发生银镜反应的物质是醛,1mol醛与银氨溶液反应只能还原出2mol Ag
C.醛类化合物既能发生氧化反应,又能发生还原反应
D.丙醛、丙酮、丙酸均能与氢气在催化剂作用下发生加成反应
难度: 中等查看答案及解析
-
等物质的量下列物质中,完全燃烧时消耗O2最少的是( )
A.甲烷 B.苯
C.乙酸丙酯 D.乙二醛(OHC﹣CHO)
难度: 简单查看答案及解析
-
将29.5g乙烷和乙烯的混合气体通入足量的溴水后,溴水质量增加7g,则混合气体中乙烯的体积分数是( )
A.21% B.25% C.30% D.35%
难度: 中等查看答案及解析
-
把含硫酸铵和硝酸铵的混合液a L分成两等份.一份加入含b mol NaOH的溶液并加热,恰好把NH3全部赶出;另一份需消耗c mol BaCl2才能使SO42﹣完全沉淀,则原溶液中NO3﹣的物质的量浓度为( )
A.
B.
C.
D.
难度: 中等查看答案及解析