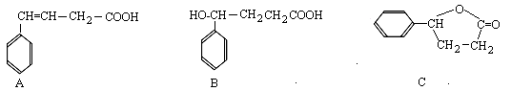
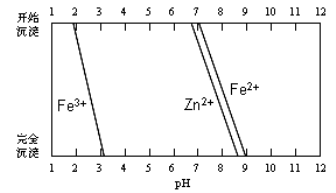
-
下列说法正确的是
A.利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料,可减少“白色污染”
B.硅晶体的导电性介于导体与绝缘体之间,是一种重要的半导体材料,广泛应用于制造集成电路、光导纤维、太阳能电池板等
C.pH计不能用于酸碱中和滴定终点的判断
D.2013年11月22日,中科院国家纳米科学中心宣布,该中心科研人员在国际上首次“拍”到氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了80多年的问题提供了直观证据。水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键。
难度: 中等查看答案及解析
-
下列说法不正确的是
A.容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗
B.在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用、普通玻璃棒进行搅拌使酸和碱充分反应、准确读取实验时温度计最高温度、并且取2-3 次的实验平均值等措施,以达到良好的实验效果
C.金属着火时,可用细沙覆盖灭火;电器设备引起的火灾,不可用泡沫灭火器灭火
D.在4mL0.1mol·L-1的K2Cr2O7溶液中滴加数滴1mol·L-1的NaOH溶液,溶液颜色从橙色变成黄色
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W、Q在元素周期表中的位置如图所示,其中X元素原子最外层电子数是最内层电子数的3倍,则下列说法正确的是
X
Y
Z
W
Q
A.X、W能与钠形成摩尔质量相同的化合物,且阴阳离子数比为1∶2
B.含X和Z元素的常见化合物为分子晶体
C.氧化物对应的水化物酸性:W<Q
D.原子半径大小关系:Q>W>Z>Y
难度: 中等查看答案及解析
-
下列说法正确的是
A.淀粉、纤维素和油脂都属于天然高分子化合物
B.蛋白质溶液中加入硫酸铜溶液,有白色沉淀产生,加水,白色沉淀重新溶解
C.等质量的CH4、C2H4、C2H2分别在氧气中完全燃烧,消耗氧气的量依次减少
D.分子式为C2H4O2与C4H8O2的两种物质一定属于同系物
难度: 简单查看答案及解析
-
用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH同时得到某种副产物,其原理如图所示(电极材料为石墨)。下列说法不正确的是
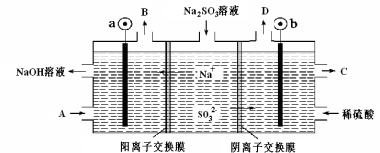
A.b电极上的主反应是 SO32--2e-+H2O===SO42-+2H+
B.若D是混合气体,则可能含有SO2、O2等成分
C.a 电极发生还原反应,当有1mol Na+通过阳离子交换膜时,a极生成11.2L气体
D.A溶液是稀NaOH溶液,作用是增强溶液的导电性;C是较浓的硫酸溶液
难度: 困难查看答案及解析
-
常温下,H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如右图所示[已知Ca3(PO4)2难溶于水]。下列有关说法不正确的是

A.H3PO4的Ka3=10-12.2,HPO42-的水解平衡常数为10-6.8
B.Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性
C.为获得尽可能纯的NaH2PO4,pH应控制在4~5.5左右
D. pH=13时,溶液中各微粒浓度大小关系为:c(Na+)>c(HPO42-)>c(PO43-)>c(OH-)>c(H+)
难度: 困难查看答案及解析
-
某无色溶液中可能含有以下离子中的一种或几种:Na+、Ag+、Fe3+、NH4 +、Al3+、CO32-、AlO2-、S2O32-、SO42-。现取该溶液进行有关实验,实验结果如图所示:
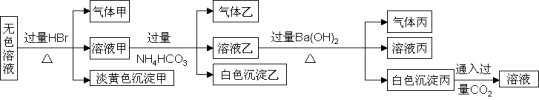
下列说法不正确的是
A.淡黄色沉淀甲不可能为AgBr
B.由溶液甲生成气体乙的途径只有:Al3++3HCO3-===Al(OH)3↓+3CO2↑
C.气体甲可能是混合气体
D.综合上述信息可以确定肯定存在的离子有:Na+、AlO2-、S2O32-
难度: 困难查看答案及解析