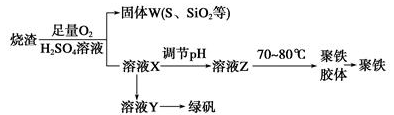
-
设NA为阿伏加德罗常数的值。下列说法中正确的是
A.1molCaC2中含有阴离子数目为2NA
B.向FeI2溶液中通入氯气,当有2molFe2+被氧化时,转移电子的数目为2NA
C.2.8g乙烯与丙烯的混合物中含碳原子的数目为0.4 NA
D.用磁铁矿炼铁的反应中,1 mol Fe3O4被CO还原成Fe,转移电子数目为8 NA
难度: 中等查看答案及解析
-
下列说法正确的是
A.随原子序数递增,ⅦA族元素的最高价氧化物对应水化物酸性逐渐增强
B.第三周期元素中(除稀有气体元素)简单离子半径最小的元素,其氧化物具有两性
C.第三周期气态氢化物的沸点均为同主族中沸点最低的,是因为其分子内含有氢键
D.第二周期元素(除稀有气体元素)的最高化合价数值逐渐增大
难度: 简单查看答案及解析
-
关于化学键的叙述正确的是
A.离子化合物中只存在离子键
B.非金属元素组成的化合物中可能存在离子键
C.由不同种元素组成的多原子分子里,一定只存在极性共价键
D.含金属元素的化合物中一定存在离子键
难度: 简单查看答案及解析
-
下列溶液中的离子一定能大量共存的是
A.能使酚酞变红色的溶液中:
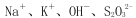
B.在加入铝粉能产生氢气的溶液中:

C.室温下由水电离出的氢离子浓度
 的溶液中:
的溶液中:
D.含大量Cu2+的溶液中:

难度: 中等查看答案及解析
-
下列关于实验的叙述合理的是
A.某氢化物的溶液能使石蕊试液变蓝,该氢化物一定是氨气
B.在Fe(OH)3胶体中和Fe(NO3)3溶液中分别逐滴加入HI稀溶液至过量,整个过程中现象相同
C.配制硫酸亚铁溶液时应将硫酸亚铁固体溶于浓硫酸中,再稀释至所需浓度,以防止水解
D.酸性高锰酸钾溶液、品红溶液、硫化钠溶液都能将SO2和CO2气体区别开
难度: 中等查看答案及解析
-
某溶液中含有
 ,向该溶液中通入过量的Cl2,下列判断正确的是
,向该溶液中通入过量的Cl2,下列判断正确的是①反应前后,溶液中离子浓度基本保持不变的有
②有胶状物质生成 ③有气体产生 ④溶液颜色发生变化 ⑤共发生了2个氧化还原反应
A.①②③④ B.②③④ C.①③⑤ D.②④⑤
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是

难度: 中等查看答案及解析
-
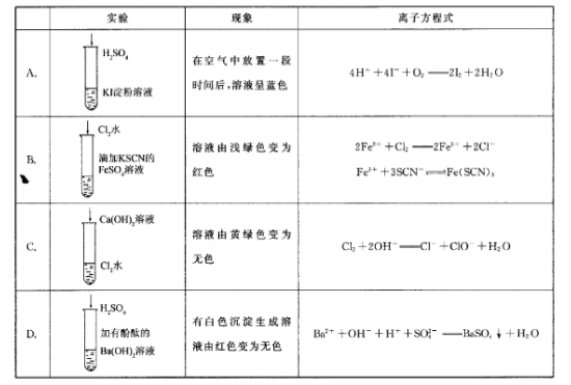
下列实验现象所对应的离子方程式不正确的是
难度: 中等查看答案及解析
-
四个等体积的圆底烧瓶分别充满①NH3②HCl③NO2④NO2 和O2的混合物进行喷泉实验,如图所示,经充分反应后,瓶内溶液的物质的量浓度大小关系为
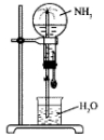
A.①>②>③>④ B.①=②=③=④
C.①=②=③>④ D.①=②>③>④
难度: 中等查看答案及解析
-
某溶液中含有HCO3-、CO32-、SO32-、Na+、NO3-五种离子,若向其中加入Na2O2粉末充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是
A.NO3- B.CO32-、NO3-
C.SO32-、NO3- D.CO32-、NO3-、Na+
难度: 中等查看答案及解析
-
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A.60 mL B.45 mL C.30 mL D.15 mL
难度: 中等查看答案及解析
-
下列有关离子方程式与所述事实相符的是
A.用过氧化氢从酸化的海带灰浸出液中提取碘:

B.某溶液中存在大量
 ,加入NaOH溶液发生反应:
,加入NaOH溶液发生反应:=Fe(OH)3↓
C.向AlCl3溶液中投入过量的Na:

D.将Na2O2固体投入H218O中:

难度: 中等查看答案及解析
-
下列关于实验的叙述正确的是
A.将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置,下层溶液呈紫红色,说明氧化性:Br2>Fe3+>I2
B.检验AlNH4(SO4)2溶液中的NH4+:取样于试管中,向溶液中加入少量NaOH溶液,加热,用湿润的红色石蕊试纸检验产生的气体
C.检验Na2S2O3和Na2SO4的混合溶液中的SO42-:先加足量稀盐酸,再加氯化钡溶液
D.检验FeBr2溶液中的Fe2+:不能使用酸性高锰酸钾溶液
难度: 中等查看答案及解析
-
下列气体的干燥和吸收方法正确的是
A.氨气可以用五氧化二磷干燥
B.氮气和氢气反应合成氨气由于反应物转化率较低,用水吸收该混合气体中的氨气不用防倒吸
C.浓硫酸不能干燥硫化氢气体,应该用碱石灰
D.制得的氯气中混有杂质氯化氢气体可用饱和碳酸氢钠溶液吸收
难度: 简单查看答案及解析
-
在淀粉碘化钾溶液中通入少量氯气,溶液立即变蓝色,在蓝色溶液中通入SO2气体,发现蓝色逐渐消失,继续加入BaCl2溶液,可产生白色沉淀。据此判断出
A.SO2氧化性比I2强
B.还原性:I— > SO2 > Cl—
C.Cl2能氧化I—和SO2
D.最后溶液中溶液一定含有Cl—、SO42-和I2
难度: 中等查看答案及解析
-
某溶液中含有较大量的Mg2+、Ag+、Ba2+ 3种阳离子,欲将3种离子逐一沉淀出来,下列加入试剂的顺序中,正确的是
①NaOH溶液、NaCl溶液、Na2SO4溶液
②NaOH溶液、Na2SO4溶液、NaCl溶液
③NaCl溶液、Na2SO4溶液、NaOH溶液
④NaCl溶液、NaOH溶液、Na2SO4溶液
A.①② B.③④ C.①③ D.②④
难度: 中等查看答案及解析
-
根据下图海水综合利用的工业流程图,判断下列说法正确的是
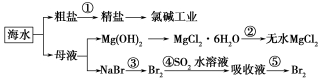
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A.除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.在过程②中将MgCl2·6H2O灼烧即可制得无水MgCl2
C.从能量角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程
D.从第③步到第④步的目的是为了浓缩富集溴
难度: 困难查看答案及解析
-
W、X、Y、Z均是短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z- ,Y+和Z-离子具有相同的电子层结构。下列说法正确的是
A. 原子最外层电子数:X>Y>Z B.单质沸点:X>Y>Z
C.原子序数:X>Y>Z D.离子半径:X2>-Y+>Z-
难度: 简单查看答案及解析
-
下表为六种短周期元素的部分性质:下列有关说法错误的是
元素代号
X
Y
Z
Q
R
T
原子半径/10-10m
0.77
0.74
0.75
1.17
0.99
1.10
主要化合价
+4、
-4
-2
+5、
-3
+4、
-4
+7、
-1
+5、
-3
A.X与Y可以形成阴离子XY32-
B.元素R的氧化物对应的水化物一定为强酸
C.Z的氢化物的沸点比T的氢化物的沸点高
D.由X形成的化合物XY2和XR4,其中XR4的沸点高
难度: 中等查看答案及解析
-
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
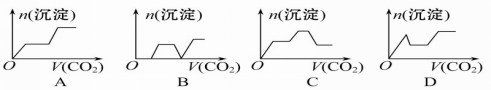
难度: 困难查看答案及解析
-
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只能被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是
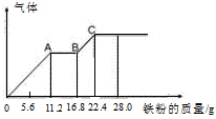
A.混合酸液中NO3-的物质的量为0.4mol
B.OA段产生是NO,AB段反应为2Fe3++Fe = 3Fe2+,BC段产生氢气
C.溶液中最终溶质为FeSO4
D.c(H2SO4)为5 mol·L-1
难度: 困难查看答案及解析