-
化学物质丰畜多彩,其与生产、生活密切相关。下列物质的用途不正确的是
A. 食醋可用于除去暖水瓶中的水垢 B. 纯碱可除去灶具上的油污
C. 酒精可用于杀菌消毒 D. 单质硅可用作光缆
难度: 简单查看答案及解析
-
用
表示阿伏加德罗常数的值.下列叙述正确的是
A. 1mol碳正离子(
)所含质子总数为8
B. 常温常压下,46g
和
混和气体中含原子总数为3
C. 标准状况下,11.2L氟化氢中含有氟原子的数目为0.5
D. 14g
原子形成的石墨中,所含C—C健的个数为
难度: 困难查看答案及解析
-
X、Y、Z、W、Q是原子序教依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体, X、Y、W在周期表中的相对位里关系如图.下列说法正确的是

A. 五种元素中,原子半径最大的是W
B. Y的氢化物的沸点比W的氢化物的沸点低
C. Y与Z 形成的化合物都可以和盐酸反应
D. Z与Q形成的化合物的水解液一定显酸性
难度: 中等查看答案及解析
-
用下图装置制取、提纯并收集下表中的四种气体(a、b、c、d表示相应仪器中加入的试剂,收集装置略去)。其中可行的是
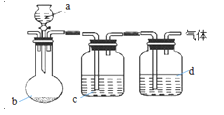
气体
a
b
c
d
A
稀硫酸
石灰石
饱和
溶液
浓
B
浓盐酸
固体
饱和
溶液
浓
C
饱和
溶液
消石灰
碱石灰
D
硝酸
锌粒
难度: 中等查看答案及解析
-
氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是:
据此反应式判断,下列叙述中不正确的是
A. 电池放电时,电池负极周围溶液的PH不断增大
B. 电池放电时,正极的电极反应为:
C. 电池充电时,阳极周围溶液的的PH不断减小
D. 电池充电时,阴极的电极反应为:2
+2
难度: 困难查看答案及解析
-
下列项目判断,结论正确的是
选项
项目
结论
A
三种有机化合物:乙烷、氯乙烯、苯
分子内所有原子均在同一平面上
B
C4H8Cl2的同分异构体数目(不考虑立体异构)
共有10种
C
乙烯和苯都能使溴水褪色
褪色的原理相同
D
由乙酸和乙醇制乙酸乙酯,油脂水解
均属于取代反应
难度: 困难查看答案及解析
-
有机化合物A的分子式是C13H20O8(相对分子质量为304),1molA在酸性条件下与4mol
反应得到4molCH3COOH和1molB.下列说法错误的是
A. A和B的相对分子质量之差为168
B. B一定不能发生加成反应
C. 有机物B与CH3CH2OH互为同系物
D. 分子式为C5H1002且与CH2COOH属于同类物质的有机物只有4种
难度: 困难查看答案及解析
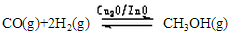 △H=-128.1kJ·mol-1,回答下列问题:
△H=-128.1kJ·mol-1,回答下列问题: