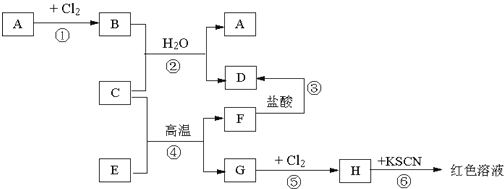
-
某元素的原子最外层电子排布是5s25p1,该元素或其化合物不可能具有的性质是( )
A. 该元素单质是导体
B. 该元素单质在一定条件下能与盐酸反应
C. 该元素的最高价氧化物的水化物显碱性
D. 该元素的最高化合价呈+5价
难度: 中等查看答案及解析
-
门捷列夫的突出贡献是( )
A. 提出原子学说 B. 提出分子学说
C. 发现元素周期律 D. 发现能量守恒定律
难度: 简单查看答案及解析
-
近几年,国际上提出了“预防污染”这一概念,绿色化学是“预防污染”的根本手段。针对“吸烟”而言,下列活动属于实施绿色化学活动的是( )
A. 处理废弃物——烟灰、烟蒂
B. 治理污染点——通风,排除烟雾
C. 减少有毒物——使用过滤嘴、低焦油烟
D. 杜绝污染物——禁烟、戒烟
难度: 简单查看答案及解析
-
核电是一种高效能源,也是一种高危能源。例如会泄露出
,当达一定浓度时,会对人体有伤害。
中质子数比中子数少:
A. 131 B. 53 C. 25 D. 78
难度: 简单查看答案及解析
-
下列各组中的两种微粒,互为同位素的是
A.H2O和H2O2 B.D2和T2 C.12C和14C D.O2和O3
难度: 中等查看答案及解析
-
以下能级符号不正确的是( )
A. 3s B. 3p C. 3d D. 3f
难度: 中等查看答案及解析
-
下列分子的电子式书写正确的是
A. 氨气
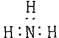 B. 四氯化碳
B. 四氯化碳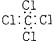
C. 氮气
D. 二氧化碳
难度: 简单查看答案及解析
-
下列各原子或离子的电子排列式错误的是
A. Na+1s22s22p6 B. F-1s22s22p6
C. N3+ 1s22s22p6 D. O2-1s22s22p6
难度: 简单查看答案及解析
-
下列分子中含有“手性碳原子”的是( )
A. CBr2F2 B. CH3CH2CH2OH C. CH3CH2CH3 D. CH3CH(NO2)COOH
难度: 中等查看答案及解析
-
下列关于氢原子电子云图的说法正确的是
A. 通常用小黑点来表示电子的多少,黑点密度大,电子数目大。
B. 黑点密度大,单位体积内电子出现的机会大。
C. 通常用小黑点来表示电子绕核作高速圆周运动。
D. 电子云图是对运动无规律性的描述。
难度: 简单查看答案及解析
-
道尔顿的原子学说曾经起了很大作用。他的学说中,包含有下述三个论点:①原子是不能再分的粒子;②同种元素的原子的各种性质和质量都相同;③原子是微小的实心球体。从现代观点看,你认为这三个论点中不确切的
A. 只有③ B. 只有①③ C. 只有②③ D. 有①②③
难度: 简单查看答案及解析
-
关于下列反应,说法正确的是:(图中共有三种原子)
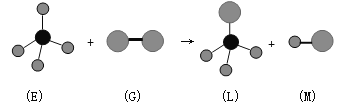
A.反应过程中E中共价键断裂,G中共价键保持不动
B.E中存在非极性键
C.M分子有可能是HCl
D.上述反应的类型是加成反应
难度: 简单查看答案及解析
-
实验测得 BeCl2为共价化合物,两个Be—Cl键间的夹角为180°。由此可见,BeCl2属于
A. 由极性键构成的极性分子
B. 由极性键构成的非极性分子
C. 由非极性键构成的极性分子
D. 由非极性键构成的非极性分子
难度: 简单查看答案及解析
-
下列轨道表示式能表示氮原子的最低能量状态的是 ( )
A.

B.
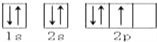
C.

D.

难度: 简单查看答案及解析
-
下列卤化氢分子中键长最短的是
A.HF B.HCl C.HBr D.HI
难度: 简单查看答案及解析
-
下列说法不正确的是
A.离子键没有方向性和饱和性
B.并不是只有活泼的金属和非金属化合才形成离子键
C.离子键的实质是静电作用
D.静电作用只有引力
难度: 简单查看答案及解析
-
据某科学杂志报道,国外有一研究发现了一种新的球形分子,它的分子式为C60Si60,其分子结构好似中国传统工艺品“镂雕”,经测定其中包含C60,也有Si60结构。下列叙述正确的是( )
A. 该物质有很高的熔点、很大的硬度
B. 该物质形成的晶体属分子晶体
C. 该物质分子中Si60被包裹在C60里面
D. 该物质的摩尔质量为2400
难度: 中等查看答案及解析
-
A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的电负性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是
A. A、B、C、D、E B. E、C、D、B、A
C. B、A、D、C、E D. C、D、A、B、E
难度: 中等查看答案及解析
-
某物质的晶体晶胞中含有A、B、C三种元素,其晶胞如图所示(其中前后两面面心中的B元素的原子未能画出)。晶体中A、B、C的原子个数比为
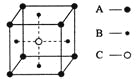
A. 1∶3∶1 B. 2∶3∶1 C. 2∶2∶1 D. 1∶3∶3
难度: 中等查看答案及解析
-
与Ne的核外电子排布相同的离子跟与Ar的核外电子排布相同的离子所形成的离子化合物是
A. MgBr2 B. Na2S C. KCl D. SO2
难度: 中等查看答案及解析
-
氮化硼是一种新合成的结构材料,它是一种超硬、耐磨、耐高温的物质。下列各组物质熔化时所克服的微粒间作用力与氮化硼熔化所克服的微粒间的作用力相同的是( )
A. 硝酸钠和金刚石 B. 晶体硅和水晶
C. 冰和干冰 D. 苯和碘
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. 冰融化时,分子中H—O键发生断裂
B. 原子晶体中,共价键越强,熔点越高
C. 分子晶体中,共价键键能越大,该分子晶体的熔、沸点一定越高
D. 分子晶体中,分子间作用力越大,该物质越稳定
难度: 简单查看答案及解析
-
共价键、离子键和范德华力是粒子之间的三种作用力。下列晶体①Na2O2 ②SiO2 ③石墨 ④金刚石 ⑤NaCl ⑥白磷中,含有两种作用力的是
A. ①②③ B. ①③⑥ C. ②④⑥ D. ①②③⑥
难度: 简单查看答案及解析
-
用NA表示阿佛加德罗常数,下列说法正确的是
A.22.4L H2的物质的量约为1mol
B.标准状况下,11.2L H2O的物质的量约为0.5 mol
C.1 L 1mol/L的MgCl2溶液中Cl-的物质的量浓度为 2mol/L
D.0.1mol铁与足量的盐酸完全反应,铁失去的电子数为0.3NA
难度: 中等查看答案及解析