-
化学与社会、科学、技术、环境密切相关。下列说法不正确的是
A. T-碳是一种新型三维碳结构晶体,与C60互为同素异形体
B. 推广利用CO2合成聚碳酸酯可降解塑料符合低碳经济理念
C. 将金属钛、铝混合后在空气中熔化可制得强度较大的钛合金材料
D. 为汽车安装尾气催化转化装置,可将尾气中的部分CO和NO转化为无毒气体
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数的值。下列有关叙述正确的是
A. 常温常压下,1.8g甲基(—CD3)中含有的中子数为NA
B. 2.3g钠被O2完全氧化时,钠得到的电子数目为0.1NA
C. 9.2g甲苯被酸性KMnO4氧化生成苯甲酸时,反应中转移电子数为0.6NA
D. 常温下,1L pH=9的CH3COONa溶液中,发生电离的水分子数为1×10-9 NA
难度: 中等查看答案及解析
-
四种常见有机物的比例模型如下图。下列说法正确的是
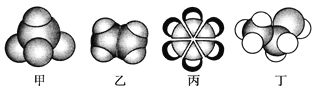
A. 乙可与溴水发生取代反应而使溴水褪色
B. 甲能使酸性KMnO4溶液褪色
C. 丙中的碳碳键是介于碳碳单键和碳碳双键之间的特殊的键
D. 丁为醋酸分子的比例模型
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W在周期表中位置如图,其中W原子的次外层电子数是最内层电子数与最外层电子数的电子数之和。下列说法不正确的是
A. 最简单的氢化物的沸点:X>W
B. 元素的非金属性:Z>W>Y
C. 简单离子的半径大小:Y>W>Z
D. 氧化物对应水化物的酸性:Y<W<Z
难度: 简单查看答案及解析
-
硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如下。该电池工作时的反应为4VB2+11O2=4B2O3+2V2O5。下列说法正确的是
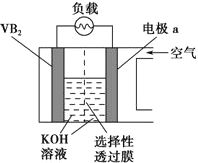
A. 电极a为电池负极
B. 反应过程中溶液的pH升高
C. 电池连续反应过程中,选择性透过膜采用阳离子选择性膜
D. VB2极的电极反应式为:2VB2 + 22OH−-22e−=V2O5+ 2B2O3+ 11H2O
难度: 中等查看答案及解析
-
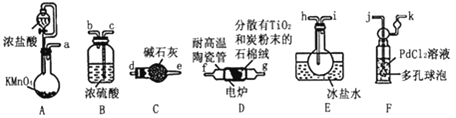
用下列实验装置进行相应实验,能达到实验目的的是

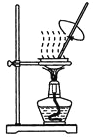
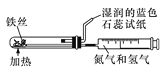
甲 乙 丙 丁
A. 用装置甲进行中和热的测定
B. 用装置乙制取CO2气体
C. 用装置丙蒸发CH3COONa溶液得CH3COONa晶体
D. 用装置丁模拟工业制氨气并检验产物
难度: 中等查看答案及解析
-
向10mL 1 mol·L-1的HCOOH溶液中不断滴加1 mol·L-1的NaOH溶液,并一直保持常温,所加碱的体积与-lg c水(H+)的关系如图所示。c水(H+)为溶液中水电离的c(H+)。下列说法不正确的是
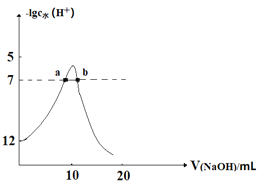
A. 常温下,Ka(HCOOH)的数量级为10-4
B. a、b两点pH均为7
C. 从a点到b点,水的电离程度先增大后减小
D. 混合溶液的导电性逐渐增强
难度: 中等查看答案及解析
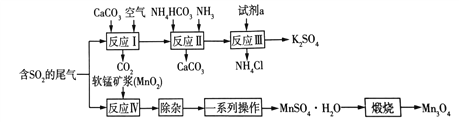

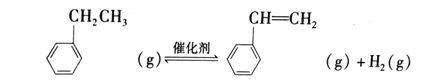 △H(1)已知:
△H(1)已知: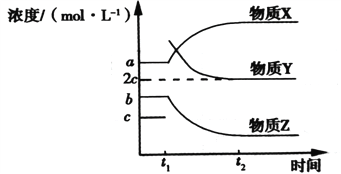
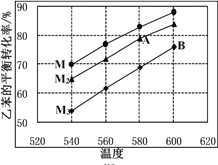
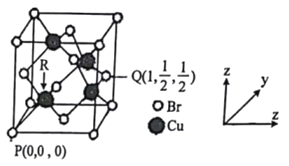
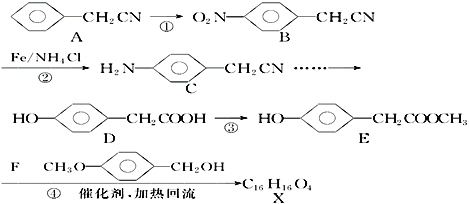
 的合成路线图(无机试剂任用)____________。
的合成路线图(无机试剂任用)____________。