-
(本题满分18分)二甲 醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
| 编号 | 热化学方程式 | 化学平衡常数 |
| ① | CO(g)+2H2(g) CH3OH(g)△H1 CH3OH(g)△H1 | K1 |
| ② | 2CH3OH(g) CH3OCH3(g)+H2O(g)△H2=﹣24kJ•mol﹣1 CH3OCH3(g)+H2O(g)△H2=﹣24kJ•mol﹣1 | K2 |
| ③ | CO(g)+H2O(g) CO2(g)+H2(g)△H3=﹣41kJ•mol﹣1 CO2(g)+H2(g)△H3=﹣41kJ•mol﹣1 | K3 |
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H﹣H | C﹣O | C=O | H﹣O | C﹣H |
| E/(kJ.mol﹣1) | 436 | 343 | 1076 | 465 | 413 |
由上述数据计算△H1= ;
(2)该工艺的总反应为3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)△H,该反应△H= ,化学平衡常数K= (用含K1、K2、K3的代数式表示);
CH3OCH3(g)+CO2(g)△H,该反应△H= ,化学平衡常数K= (用含K1、K2、K3的代数式表示);
(3)下列措施中,能提高CH3OCH3产率的有 ;
A.分离出二甲醚 B.升高温度
C.改用高效催化剂 D.增大压强
(4)工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.该工艺中反应③的发生提高了CH3OCH3的产率,原因是 ;
(5)以n(H2)/n(CO)=2 通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是 ;
CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是 ;

A.该反应的△H>0
B.若在p2和316℃时反应达到平衡,则CO的转化率小于50%
C.若在p3和316℃时反应达到平衡,H2的转化率等于50%
D.若在p3和316℃时,起始时n(H2)/n(CO)=3,则达平衡时CO的转化率大于50%
E.若在p1和200℃时,反应达平衡后保持温度和压强不变,再充入2mol H2和1mol CO,则平衡时二甲醚的体积分数增大
(6)某温度下,将8.0mol H2和4.0mol CO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g)⇌CH3OCH3(g)+H2O(g),反应达平衡后测得二甲醚的体积分数为25%,则该温度下反应的平衡常数K= .
-
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
| 方法I | 用碳粉在高温条件下还原CuO |
| 方法II | 用肼(N2H4)还原新制Cu(OH)2 |
| 方法III | 电解法,反应为2Cu+H2O Cu2O+H2↑ Cu2O+H2↑ |
(1)已知:2Cu(s)+ O2(g)=Cu2O(s)△H=﹣akJ•mol﹣1
O2(g)=Cu2O(s)△H=﹣akJ•mol﹣1
C(s)+ O2(g)=CO(g)△H=﹣bkJ•mol﹣1
O2(g)=CO(g)△H=﹣bkJ•mol﹣1
Cu(s)+ O2(g)=CuO(s)△H=﹣ckJ•mol﹣1
O2(g)=CuO(s)△H=﹣ckJ•mol﹣1
则方法I发生的反应:2Cu O(s)+C(s)=Cu2O(s)+CO(g);△H= kJ•mol﹣1.
(2)工业上很少用方法I制取Cu2O,是由于方法I反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因: .
(3)方法II为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.
该制法的化学方程式为 .
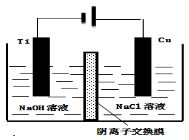
(4)方法III采用离子交换膜控制电解液中OH﹣的浓度而制备纳米Cu2O,装置如图所示,写出电极反应式
并说明该装置制备Cu2O的原理 .
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g)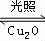 2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)
2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)
变化如下表所示.
| 序号 | Cu2O a克 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | 方法II | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | 方法III | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | 方法III | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是 (填字母代号).
a.实验的温度:T2<T1
b.实验①前20min的平均反应速率v(O2)=7×10﹣5mol•L﹣1•min﹣1
c.实验②比实验①所用的Cu2O催化效率高
d. 实验①、②、③的化学平衡常数的关系:K1=K2<K3.
-
短周期主族元素A、B、C、D、E原子序数依次增大,A是周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C原子的最外层电子数是次外层电子数的3倍,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物分子含有相同的电子数.
(1)A、C、D形成的化合物中含有的化学键类型为 .
(2)已知:
①E﹣E→2E△H=+a kJ•mol﹣1;
②2A→A﹣A△H=﹣b kJ•mol﹣1;
③E+A→A﹣E△H=﹣c kJ•mol﹣1;
写出298K时,A2与E2反应的热化学方程式 .
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)⇌X(g)△H=﹣a kJ•mol﹣1(a>0,X为A、B、C三种元素组成的一种化合物).初始投料与各容器达到平衡时的有关数据如下:
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2molA2、1molBC | 1molX | 4molA2、2molBC |
| 平衡时n(X) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
①在该温度下,假设甲容器从反应开始到平衡所需时间为4min,则A2的平均反应速率v(A2)= .
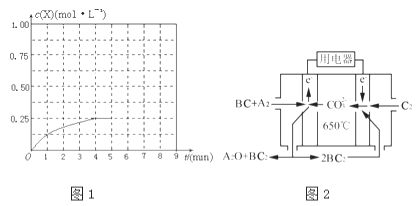
②计算该温度下此反应的平衡常数K= .
③三个容器中的反应分别达平衡时各组数据关系正确的是 (填字母).
A.α1+α2=1
B.Q1+Q2=a
C.α3<α1
D.P3<2P1=2P2
E.n2<n3<1.0mol
F.Q3=2Q1
④在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为75%,请在图1中画出第5min到新平衡时X的物质的量浓度的变化曲线.
(4)熔融碳酸盐燃料电池(MCFC)是一种高温燃料电池,被称为第二代燃料电池.目前已接近商业化,示范电站规模已达2MW,从技术发展趋势来看,是未来民用发电的理想选择方案之一.现以A2(g)、BC(g)为燃料,以一定比例Li2CO3和Na2CO3低熔混合物为电解质.写出碳酸盐燃料电池(MCFC)正极电极反应式 .
B. 次氯酸的结构式:H-Cl-O
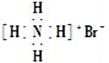 D. 质子数为53,中子数为78的碘原子:
D. 质子数为53,中子数为78的碘原子:2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应
速率与反应时间的关系如图所示.下列说法正确的是


﹣+2H+
Cl2↑+H2↑
B.H2O:0.002mol•L﹣1


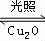 2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)
2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)