-
现有等体积混合而成的4 组气体: ①NO2+NO. ②HCl+N2 ③NO2+O2 ④Cl2+SO2。 现将其分别通入体积相同的试管中并立即倒立在足量水中,试管内剩余的气体体积分别为V1、V2、V3、V4,则下列关系正确的是
A. V1>V3>V2>V4 B. V1>V2>V3>V4 C. V2>V3>V4>V1 D. V3>V1>V4>V2
难度: 中等查看答案及解析
-
化学与人类的生产、生活息息相关,下列说法正确的是( )
A. 在燃煤中加入生石灰可减少SO2的排放
B. “温室效应”、“酸雨”的形成都与氮氧化合物有关
C. 绿色化学的核心是对环境污染进行综合治理
D. 高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路”
难度: 中等查看答案及解析
-
化学与生产、生活密切相关。下列说法不正确的是( )
A. 黑陶有“乌金墨玉”之誉,属于硅酸盐制品
B. 人类对金属材料的使用过程中,性质不活泼的金属单质更早被人们使用
C. 多数合金比各成分金属熔点高、硬度大
D. 工业用Na2S处理废水中的Cu2+、Hg2+等重金属离子
难度: 中等查看答案及解析
-
下列关于硅单质及其化合物的说法不正确的是( )
A. 水玻璃是一种矿物胶,既不易燃烧也不易腐蚀
B. 水泥、玻璃、石英都是硅酸盐制品
C. 氮化硅(Si3N4)是一种重要的结构陶瓷材料
D. 向Na2SiO3溶液中逐滴加入稀盐酸制备硅酸
难度: 中等查看答案及解析
-
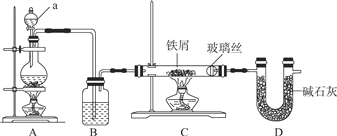
下列实验装置及说法正确的是( )
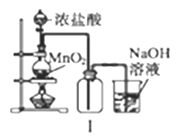

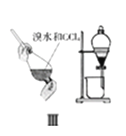

A. Ⅰ图中:实验室制备氯气,若MnO2过量,则浓盐酸可被全部消耗
B. Ⅱ图中:实验室制备氨气,棉花的作用是用来减小空气对流
C. Ⅲ图中:利用CCl4萃取溴,上层为CCl4层
D. Ⅳ图中:若气球干瘪,证明Cl2可与NaOH反应
难度: 中等查看答案及解析
-
已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行氯气的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )

①
②
③
④
A
黄绿色
橙色
蓝色
无色
B
无色
橙色
紫色
无色
C
黄绿色
橙色
蓝色
白色
D
黄绿色
无色
紫色
白色
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法中正确的是( )
A. 标准状况下,1molSO3的体积为22.4L
B. 1mol 二氧化氮与足量的水反应电子转移总数为3NA
C. 标准状况下,将22.4LSO2通入水中形成1L溶液,得到H2SO3的浓度为1mol/L
D. 常温下,23gNO2和N2O4的混合气体中含有NA个氧原子
难度: 中等查看答案及解析
-
下列解释事实的方程式,正确的是( )
A. 过量的氨气与氯气反应:2NH3+3Cl2
N2+6HCl
B. 利用HF雕刻玻璃:SiO2+4H++4F—=SiF4+2H2O
C. 石灰乳吸收泄漏的液氯:2Cl2+2Ca(OH)2=2Ca2++2Cl—+2ClO—+2H2O
D. SO2的尾气处理:OH—+SO2=SO32—+H2O
难度: 中等查看答案及解析
-
A是一种常见的单质,B、C为中学化学常见的化合物,A、B、C均含有元素X。它们有如图所示的转化关系(部分产物及反应条件已略去)。下列说法中不正确的是 ( )
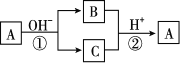
A. X元素可能为Al B. X元素一定为非金属元素
C. A可能是Cl2 D. 反应①和②一定为氧化还原反应
难度: 中等查看答案及解析
-
下列离子的检验能达到预期目的是( )
A. 检验
:先滴加氯水,再滴加KSCN溶液,若变红,则有Fe2+
B. 检验NH4+:先滴加NaOH溶液,加热,用湿润蓝色石蕊试纸检验,若变红,则有NH4+
C. 检验Cl—:先滴加AgNO3溶液,再滴加硝酸,若有白色沉淀,则有Cl—
D. 检验
:滴加硝酸,将生成的气体通入品红溶液,若品红溶液褪色,则有
难度: 中等查看答案及解析
-
下表各选项中,不能利用置换反应通过Y得到W的一组化合物是( )
选项
化合物
A
B
C
D
Y
H2O
FeCl3
H2O
C
W
HF
CuCl2
Fe3O4
Si
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
如图所示,将Ⅰ阀关闭,Ⅱ阀打开,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是
①浓硫酸 ②饱和氯化钠溶液 ③NaOH溶液 ④饱和碳酸钠溶液 ⑤水

A. ①③ B. ②⑤ C. ②③⑤ D. ①③④
难度: 困难查看答案及解析
-
向Na2CO3、NaHCO3混合液中逐滴加入稀盐酸,生成气体的量随稀盐酸加入量的变化关系如图,则下列离子组在对应的溶液中一定能大量共存的是( )

A. a点对应的溶液中:Ca2+、Mg2+、Br—、NO3—
B. b点对应的溶液中:Na+、OH—、Cl—、NO3—
C. c点对应的溶液中:Na+、Ca2+、NO3—、Cl—
D. d点对应的溶液中:F—、NO3—、Fe2+、Ag+
难度: 中等查看答案及解析
-
某无色混合气体,可能含有CO、H2、SO2、Cl2、HCl中的一种或几种,把此混合气体通过少量澄清石灰水,最终无沉淀生成;再通过少量品红溶液,完全褪色;随后将该气体通过足量的氢氧化钠溶液后,再通过足量红热的CuO粉末,粉末变成红色;最后通入CaCl2溶液中,无沉淀生成,则下列关于此混合气体的叙述正确的是( )
A. 澄清石灰水中无沉淀,说明一定不含有SO2
B. 品红褪色,可能是Cl2导致的
C. 无法判断原混合气体中有无HCl
D. CaCl2溶液中无沉淀,说明通过CuO后得到的气体中一定不含有CO2
难度: 中等查看答案及解析
-
工业上将Na2CO3和Na2S配成溶液,再通入SO2可制取Na2S2O3,同时放出CO2。下列说法不正确的是( )
A. 上述反应中氧化剂和还原剂的物质的量比是2:l
B. 上述反应中的Na2CO3和Na2S的物质的量比最佳是1:2
C. 每生成lmol Na2S2O3转移4mol电子
D. Na2S2O3既是氧化产物,又是还原产物
难度: 中等查看答案及解析
-
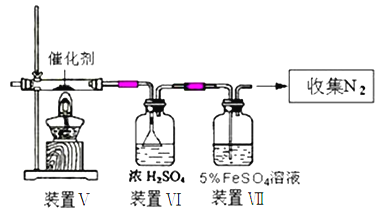
将O2和NH3的混合气体20mol与催化剂共热,充分反应后,再通过足量的水,最终收集到2mol气体,打开瓶塞,无明显实验现象。则原混合气体中O2的体积是( )
A. 6mol B. 7.2mol C. 12.8mol D. 14mol
难度: 困难查看答案及解析