-
在一个密闭容器中发生如下反应:2SO2 (g)+O2(g)⇌2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为0.2mol•L-1、0.1mol•L-1、0.2mol•L-1,当反应达到平衡时,可能出现的数据是( )
A.C(SO3)=0.4 mol•L-1
B.C(SO3)+C(SO2)=0.15 mol•L-1
C.C(O2)=0.3 mol•L-1
D.C(SO3)+C(SO2)=0.4 mol•L-1难度: 中等查看答案及解析
-
一定条件下反应2AB(g)⇌A2(g)+B2(g)达到平衡状态的标志是( )
A.单位时间内生成n mol A2,同时消耗2n mol AB
B.容器内,3种气体AB、A2、B2物资的量相等
C.在恒容容器中,容器内压强不再变化
D.容器中各组分的体积分数不随时间变化难度: 中等查看答案及解析
-
在密闭容中发生下列反应aA(g)⇌cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
A.A的转化率变小
B.平衡向正反应方向移动
C.D的体积分数变大
D.a>c+d难度: 中等查看答案及解析
-
下列反应的能量变化与其它三个不相同的是( )
A.铝粉与氧化铁的反应
B.氯化铵与消石灰的反应
C.锌片与稀硫酸反应
D.钠与冷水反应难度: 中等查看答案及解析
-
在钢铁腐蚀过程中,下列五种变化可能发生的是( )
①Fe由+2价转为+3价
②O2被还原、
③产生H2、
④Fe(OH)3失水形成Fe2O3•xH2O、
⑤杂质碳被氧化.
A.①②③④
B.只②③④
C.只①②
D.①②③④⑤难度: 中等查看答案及解析
-
某温度时,N2(g)+3H2(g)⇌2NH3(g)的平衡常数K=a,则此温度下,NH3(g)⇌
H2(g)+
N2(g)的平衡常数为( )
A.
B.a
C.
D.aˉ2难度: 中等查看答案及解析
-
如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
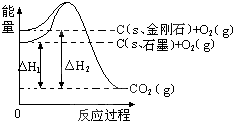
A.C(s、石墨)═C(s、金刚石),该反应的焓变为负值
B.石墨的稳定性弱于金刚石
C.石墨和金刚石的转化是物理变化
D.1 mol石墨的总键能比1 mol金刚石的总键能大1.9 kJ难度: 中等查看答案及解析
-
在一定条件下,可逆反应N2(g)+2H2(g)⇌2NH3(g)△H<0达到平衡,当单独改变下列条件后,有关叙述错误的是( )
A.加催化剂,v正、v逆都发生变化,且变化的倍数相等
B.加入氩气,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数
C.加压,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数
D.降温,v正、v逆都减小,且v正减小的倍数小于v逆减小的倍数难度: 中等查看答案及解析
-
用惰性电极电解一定量的硫酸铜溶液,实验装置如图①.电解过程中的实验数据如图②,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).则下列说法正确的是( )

A.电解过程中,b电极表面先有红色物质析出,后有气泡产生
B.a电极上发生的反应方程式为:2H++2e-=H2↑和 4OH--4e-=2H2O+O2↑
C.从P到Q点时收集到的混合气体的平均摩尔质量为12g•mol-1
D.曲线0~P段表示H2和O2混合气体的体积变化,曲线P~Q段表示O2的体积变化难度: 中等查看答案及解析
-
X、Y、Z、M代表四种金属元素.金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+共存的溶液时,Y先析出;把金属X分别浸入M2+和Y2+的盐溶液中,只有金属Y析出.则这四种金属的活动性由强到弱的顺序为( )
A.X>Z>M>Y
B.M>X>Z>Y
C.X>Y>Z>M
D.X>Z>Y>M难度: 中等查看答案及解析
-
经一定时间后,可逆反应aA+bB⇌cC中物质的含量A%和C%随温度的变化曲线如图所示.下列说法正确的是( )
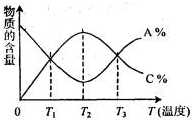
A.该反应在T1、T3温度时达到化学平衡
B.该反应在T2温度时达到化学平衡
C.该反应的逆反应是放热反应
D.升高温度,平衡会向正反应方向移动难度: 中等查看答案及解析
-
在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g)⇌xC(g),符合下图所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强).在图中,Y轴指 ( )
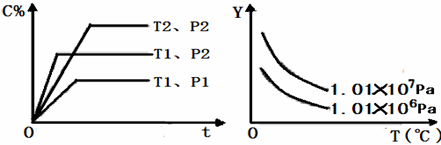
A.平衡混合气中反应物A的百分含量
B.平衡混合气中反应物B的百分含量
C.平衡混合气的密度
D.平衡混合气的平均摩尔质量难度: 中等查看答案及解析
-
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH下列叙述不正确的是( )
A.放电时负极反应为:Zn-2e-+2OH-Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-FeO42-+4H2O
C.放电时每转移3mol电子,正极有1molK2FeO4被氧化
D.放电时正极附近溶液的碱性增强难度: 中等查看答案及解析
-
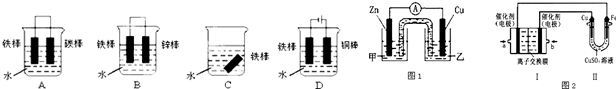
关于如图装置说法正确的是( )
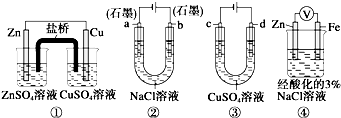
A.装置①中,盐桥中的K+移向ZnSO4溶液
B.装置②工作一段时间后,a极附近溶液的OH-的浓度增大
C.用装置③精炼铜时,c极为粗铜
D.装置④中电子由Zn流向Fe,装置中有Fe2+生成难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.凡是放热反应都是自发的,吸热反应都是非自发的
B.在反应A(g)+3B(g)=2C(g)+2D(g) 的速率测定实验中,分别测得反应速率如下:v(A)=0.15mol•L-1•s-1,v(C)=0.3 mol•L-1•s-1,则用C来表示反应进行的速率更快
C.反应HCl ( aq )+NaOH ( aq )=NaCl ( aq )+H2O ( l )△H<0,在理论上能用于设计原电池
D.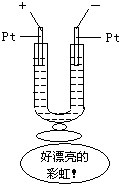
如图所示,在一U型管中装入含有紫色石蕊试液的Na2SO4溶液,通直流电,一段时间后U型管内会形成一个倒立的三色“彩虹”,从左到右颜色的次序是.红、紫、难度: 中等查看答案及解析
-
某密闭容器中发生如下反应:X(g)+3Y(g)⇌2Z(g);△H<0.如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中不正确的是( )
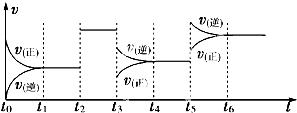
A.在t4~t5时间内,X的转化率最低
B.t3时降低了压强
C.t5时升高了温度
D.t2时加入了催化剂难度: 中等查看答案及解析