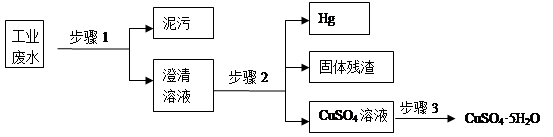
-
下列叙述正确的是
A.1 mol H2O的质量为18g/mol B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量为32g D.标准状况下,1 mol任何物质体积均为22.4L
难度: 简单查看答案及解析
-
设NA表示阿伏加得德罗常数的数值,下列叙述中正确的是
A.1 mol NH3所含有的氢原子数为3NA
B.常温常压下,22 .4 L氧气所含的原子数为2NA
C.常温常压下,48 g O3所含的氧原子数为3NA
D.1 L 0.1 mol/LNaCl溶液中所含的Na+为NA
难度: 简单查看答案及解析
-
下列实验操作中正确的是
A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球伸入液面下
C.可用酒精萃取碘水中的碘
D.用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干
难度: 中等查看答案及解析
-
在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是
A.Na+、K+、OH-、Cl- B.Na+、Cu2+ 、SO42-、NO3-
C.Mg2+、Na+、SO42-、Cl- D.Ba2+、HCO3-、NO3-、K+
难度: 中等查看答案及解析
-
胶体分散系与其它分散系的本质差别是
A.是否稳定 B.是否有丁达尔现象
C.分散质微粒的直径大小 D.分散质粒子是否带电
难度: 中等查看答案及解析
-
下列溶液中Cl-浓度与50 mL 1 mol·L-1 AlCl3溶液中Cl-浓度相等的是
A.150 mL 1 mol·L-1的NaCl溶液 B.75 mL 2 mol·L-1 NH4Cl溶液
C.150 mL 2 mol·L-1的KCl溶液 D.75 mL 1 mol·L-1的FeCl3溶液
难度: 中等查看答案及解析
-
下列反应属于氧化还原反应的是
A.H2+ Cl2
2HCl B.CaCO3+2HCl
CaCl2+CO2 ↑+H2O
C.CuSO4+BaCl2=BaSO4↓+CuCl2 D.NH4HCO3==NH3↑+CO2↑+H2O
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是
A.氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++Cu
B.稀 H2SO4与铁粉反应: Fe+2H+=Fe2++H2↑
C.氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-=BaSO4↓
D.碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
难度: 中等查看答案及解析