-
某研究性学习小组在网上收集到如下信息:钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧.他们对钠在CO2气体中燃烧后的产物中的白色物质进行了如下探究:
【实验】将燃烧的钠迅速伸入到盛有装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质.
(1)通过钠在CO2气体中燃烧的实验,你认为燃烧的条件是______.
(2)燃烧的本质是______.
(3)2010年8月初发生的俄罗斯森林大火有比伦敦市还要大的面积.控制森林火灾是世界性难题.根据燃烧的条件,请你解释为什么设置森林防火隔离带能有效阻止森林火灾的蔓延?______.
【提出假设】假设1:白色物质是Na2O.
假设2:白色物质是Na2CO3.
假设3:白色物质是Na2O和Na2CO3的混合物.
【设计实验方案.验证假设】该小组对燃烧后的白色产物进行如下探究:
【思考与交流】实验方案 实验操作 实验现象 结论 方案1 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 溶液变成红色 白色物质为Na2O 方案2 ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 出现白色沉淀 ③静置片刻,取上层清液于试管中,滴加无色酚酞试液 无明显现象
(4)甲同学认为方案1得到的结论不正确,其理由是______.
(5)乙同学认为方案2得到的结论正确,白色物质为______.
(6)通过方案1和方案2的实验,你认为上述三个假设中,______成立.你的理由是______.
(7)钠在二氧化碳中燃烧的化学方程式为______ 2Na2CO3+C难度: 中等查看答案及解析
-
有关元素X、Y、Z、W的信息如下:
请回答下列问题:元素 信息 X 所在主族序数与所在周期序数之差为4 Y 最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子 Z 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 W 该元素能形成两性氢氧化物
(1)W的单质与Y的最高价氧化物对应的水化物反应的离子方程式为______
(2)铜片、碳棒和ZX3溶液组成原电池,写出正极发生的电极反应方程式______
(3)向淀粉碘化钾溶液中滴加几滴ZX3的浓溶液,现象为______,w3+离子的结构示意图______.
(4)以上述所得WX3溶液为原料制取无水WX3,先制得WX3•6H2O晶体,主要操作包括______,在______条件下加热WX3•6H2O晶体,能进一步制取无水WX3,其原因是(结合离子方程式简要说明)______.难度: 中等查看答案及解析
-
某芳香族化合物A的分子中含有C.H、O、N四种元素,相同状况下,其蒸气的密度为氢气密度的68.5倍.现以苯为原料合成A,并最终制得F(一种染料中间体),转化关系如下(一些非主要产物己略去):
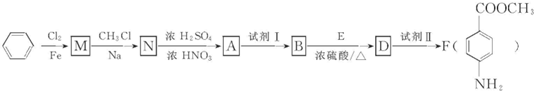
已知: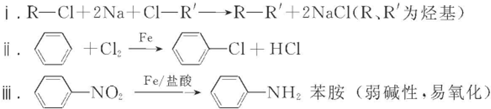
请回答下列问题:
(1)写出 A的结构简式______.
(2)N→A的反应类型是______.
(3)上述转化中试剂I和试剂Ⅱ分别是:试剂I______;试剂Ⅱ______(选填字母).
a.KMnO4(H+) b.Fe/盐酸 c.NaOH溶液
(4)用核磁共振氢谱可以证明化合物E中含有______种处于不同化学环境的氢.
(5)写出同时符合下列要求的两种D的同分异构体的结构简式:
①属于芳香族化合物,分子中有两个互为对位的取代基,其中一个取代基是硝基;
②分子中含有结构.______
(6)有一种D的同分异构体w,在酸性条件下水解后,可得到一种能与FeCl3溶液发生显色反应的产物,写出w在酸性条件下水解的化学方程式:______.
(7)F的水解反应如下: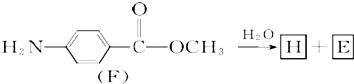 化合物H在一定条件下经缩聚反应可制得高分子纤维,广泛用于通讯、导弹、宇航等领域.请写出该缩聚反应的化学方程式:
化合物H在一定条件下经缩聚反应可制得高分子纤维,广泛用于通讯、导弹、宇航等领域.请写出该缩聚反应的化学方程式:
______.难度: 中等查看答案及解析
-
某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
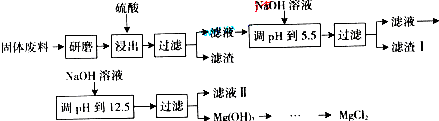
部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题:沉淀物 Fe(OH)3 Al(OH)3 Mg(OH)2 PH 3.2 5.2 12.4
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有______(要求写出两条).
(2)滤渣I的主要成分有______.
(3)从滤液Ⅱ中可回收利用的主要物质有______.
(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
MgCl2+2NaClO3═Mg(ClO3)2+2NaCl
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示: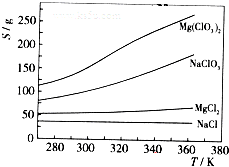
①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2.简述可制备Mg(ClO3)2的原因:______.
②按①中条件进行制备实验.在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是:______.除去产品中该杂质的方法是:______.难度: 中等查看答案及解析