-
下列气体中,与酸雨密切相关的是( )
①NO2 ②CO2 ③SO2 ④CO
A. ③ B. ①③ C. ①② D. ③④
难度: 简单查看答案及解析
-
下列过程中,涉及化学变化的是( )
A. 氯气通入水中制氯水 B. 蒸馏法将海水淡化为饮用水
C. 活性炭使红墨水褪色 D. 四氯化碳萃取碘水中的碘
难度: 简单查看答案及解析
-
某元素原子L层电子数比K层电子数多5个,该元素的最高正价为( )
A. +7 B. +5 C. +3 D. 无最高正价
难度: 简单查看答案及解析
-
已知气体的摩尔质量越小,扩散速度越快。下图所示为气体扩散速度的实验,两种气体扩散相遇时形成白色烟环。下列关于物质甲、乙的判断正确的是( )
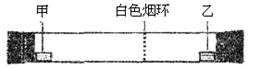
A. 甲是浓氨水,乙是浓硫酸 B. 甲是浓盐酸,乙是浓氨水
C. 甲是浓氨水,乙是浓盐酸 D. 甲是浓硝酸,乙是浓氨水
难度: 简单查看答案及解析
-
下列物质中,既含有离子键,又含有共价键的是( )
A. MgCl2 B. NH4Cl C. Na2O D. H2O2
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. SiO2是酸性氧化物,它溶于水,不溶于酸
B. SiO2是制造玻璃的主要原料之一,它在常温下不与NaOH溶液反应
C. 电脑芯片的主要成分是SiO2
D. CO2通入水玻璃中可以得硅酸
难度: 简单查看答案及解析
-
下列各组微粒中属于同位素的是( )
A. D和
H B.
Ar和
Ca C.
O2和
O3 D.
Cl和
Cl
难度: 简单查看答案及解析
-
下列关于物质性质的比较,不正确的是( )
A. 酸性强弱:HIO4>HBrO4>HClO4 B. 原子半径大小:Mg>P>N
C. 碱性强弱:KOH>NaOH>LiOH D. 金属性强弱:Na>Mg>Al
难度: 简单查看答案及解析
-
运用元素周期律分析下面的推断,其中错误的是( )
A. 铍(Be)的氧化物的水化物可能具有两性
B. 砹(At2)为有色固体;HAt不稳定;AgAt感光性很强,不溶于水也不溶于稀酸
C. 硫酸锶(SrSO4)是难溶于水的白色固体
D. 硒化氢(H2Se)是比H2S稳定的气体
难度: 简单查看答案及解析
-
下列各组离子,在指定的环境中能够大量共存的是( )
A. 有Fe3+大量存在的溶液中:Na+、Cl-、K+、SCN-
B. 滴加酚酞显红色的溶液中:NH4+、Al3+、SO42-、NO3-
C. 强酸性溶液中:MnO4-、K+、Cl-、SO32-
D. 强碱性溶液中:Na+、K+、Cl-、A1O2-
难度: 简单查看答案及解析
-
下列反应的离子方程式中,书写正确的是( )
A. 金属钾投入到蒸馏水中:K+H2O=K++OH-+H2↑
B. Fe跟稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
C. 铝粉投入到NaOH溶液中:2Al+2OH-=2A1O2-+H2↑
D. 铜跟稀硝酸反应:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
难度: 简单查看答案及解析
-
下列化工生产原理错误的是( )
①可以用电解熔融氯化钠的方法来制取金属钠②可以用钠加入氯化镁饱和溶液中制取镁③用电冶铝时,原料是氯化铝④湿法炼铜是用锌和硫酸铜溶液反应置换出铜
A. ②③ B. ①③ C. ①②③ D. ②③④
难度: 简单查看答案及解析
-
等物质的量的SO2和Cl2混合后,缓慢通入BaCl2溶液,充分反应后,再滴入品红试液,观察到的现象是( )
A. 无沉淀生成,溶液显红色 B. 无沉淀生成,溶液显无色
C. 有沉淀生成,溶液显无色 D. 有沉淀生成,溶液显红色
难度: 简单查看答案及解析
-
下列叙述中,正确的是( )
A. 门捷列夫将元素按质量数递增,并将化学性质相似的元素放在一个纵行,制出了第一张元素周期表
B. 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C. 新制氯水或亚硫酸溶液显酸性,分别向其中滴加少量紫色石蕊试液,充分振荡后溶液先变红后褪色
D. CuO与浓HNO3的反应只体现出浓HNO3的酸性
难度: 简单查看答案及解析
-
从氧化还原角度分析,下列反应中水的作用相同的是( )
①Na和H2O ②NO2和H2O ③Cl2和H2O ④Na2O2和H2O
A. ①②③ B. ①②④ C. ①③④ D. ②③④
难度: 简单查看答案及解析
-
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是( )
现象
解释
A
KI淀粉溶液中通入Cl2,溶液变蓝
Cl2能与淀粉发生显色反应
B
浓HNO3在光照条件下变黄
浓HNO3不稳定,生成有色产物能溶于浓硝酸
C
某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成
说明该溶液中含有SO42-
D
铜片放入浓硫酸中,无明显变化
说明铜在冷的浓硫酸中发生钝化
难度: 简单查看答案及解析
-
下列过程中,共价键被破坏的是( )
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水
⑤冰融化 ⑥NH4Cl受热“升华” ⑦氢氧化钠熔化 ⑧(NH4)2SO4溶于水
A. ①②④⑥⑦ B. ④⑥ C. ①④⑤⑧ D. ①②④⑤⑥⑦
难度: 简单查看答案及解析
-
在周期表主族元素中,甲元素与乙、丙、丁三元素相邻,甲、乙的原子序数之和等于丙的原子序数;这四种元素原子的最外层电子数之和为20。下列判断中正确的是( )
A. 原子半径:丙>乙>甲>丁
B. 气态氢化物的稳定性:甲>丙
C. 最高价氧化物对应水化物的酸性:丁>甲
D. 乙和甲或乙和丁所能形成的化合物都是有毒物质
难度: 简单查看答案及解析
-
单质A能从盐溶液中置换出单质B,则下列说法中,不正确的是( )
A. 当A、B都是金属时,A一定比B活动性强
B. 当A、B都是非金属时,A一定比B活动性强
C. 当A是金属时,B可能是金属,也可能是非金属
D. 当A是非金属时,B可能是金属,也可能是非金属
难度: 简单查看答案及解析
-
根据表中信息判断以下叙述,正确的是( )
短周期元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.112
0.104
0.066
主要化合价
+2
+3
+2
+6、-2
-2
A. 氢化物的沸点为H2T<H2R B. 单质与稀盐酸反应的速率为L<Q
C. M与T形成的化合物具有两性 D. L2+与R2-的核外电子数相等
难度: 简单查看答案及解析
-
硫酸和硝酸的混合溶液20mL,其中含有硫酸的浓度为2mol/L,含硝酸的浓度是1mol/L,现向其中加入0.96g铜粉,充分反应后(假设只生成NO气体),最多可收集到标准状况下的气体的体积为( )
A. 89.6mL B. 112mL C. 168mL D. 224mL
难度: 简单查看答案及解析
-
原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数是2n2-l。下列有关元素X的说法中不正确的是( )
A. 元素X能形成化学式为X(OH)3的碱
B. 元素X可能形成化学式为KXO3的含氧酸钾盐
C. 元素X原子的最外层电子数和核电荷数肯定为奇数
D. 元素X能与某些金属元素形成化合物
难度: 简单查看答案及解析
-
某溶液中可能含有Na+、Ca2+、Br-、CO32-、I-、SO32-六种离子中的几种。①在该溶液中滴加足量氯水后,有气泡产生、溶液呈橙黄色;②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成:③橙黄色溶液不能使淀粉溶液变蓝。根据上述实验事实推断,在该溶液中肯定都存在的离子组是( )
A. Na+、Br-、CO32- B. Na+、SO32-、I-
C. Ca2+、I-、SO32- D. Ca2+、CO32-、Br-
难度: 简单查看答案及解析