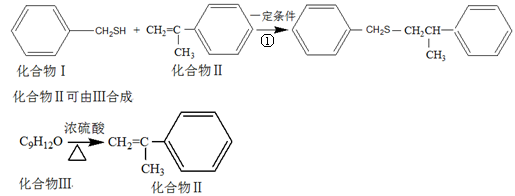
-
化学与能源、环保、资源利用、食品安全等密切相关,下列说法正确的是
A.液化石油气、汽油和石蜡的主要成分都是碳氢化合物
B.核电站泄漏的放射性碘-131
、铯-137
互称同位素,可使蛋白质变性
C.某雨水样品放置一段时间后pH由4.68变为4.28,是因为水中溶解的CO2增多
D.“地沟油”、“塑化剂”(邻苯二甲酸酯类物质)均属于高分子化合物,都对健康有害。
难度: 中等查看答案及解析
-
下列有关海水综合利用的说法正确的是
A.海水中含有钾元素,只需经过物理变化就可以得到钾单质
B.用惰性电极电解MgCl2饱和溶液,可制得金属镁
C.从海水中可以得到NaCl,电解熔融NaCl可制得金属钠
D.从海带中提取碘单质的过程不涉及氧化还原反应
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.1 molCl2与足量Fe反应转移电子数一定为3NA
B.标准状况下,2.24 L NH3中含有共价键的数目为NA
C.1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3 NA
D.标准状况下,11.2 L SO3所含的分子数目为0.5NA
难度: 中等查看答案及解析
-
能在水溶液中大量共存的离子组是
A.H+、Fe3+、ClO-、Cl- B.H+、NH4+、Fe2+、NO3-
C.Ag+、K+、Cl-、SO42- D.K+、AlO2-、Cl-、OH-
难度: 中等查看答案及解析
-
根据下列实验不能证明一元酸HR为弱酸的是
A.室温时,NaR溶液的pH大于7
B.滴加紫色石蕊试液,溶液变红色
C.HR溶液加入少量NaR固体,溶解后溶液的pH变大
D.室温时,0.01mol•L—1的HR溶液pH=4
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.金属钠和水反应:Na+H2O=Na++OH-+H2↑
B.澄清石灰水中加入通入少量CO2 :Ca2++2OH- + CO2 = CaCO3↓+H2O
C.过氧化钠与冷水反应:2O22- + 2H2O = 4OH- + O2↑
D.H2SO4与Ba(OH)2混合:SO42- +Ba2++H++OH- =BaSO4↓+H2O
难度: 中等查看答案及解析
-
已知某物质X能发生如下转化:
下列有关上述转化关系中物质及其反应的叙述错误的是
A.若X为N2或NH3,则A为硝酸
B.若X为S或H2S,则A为硫酸
C.若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y
D.反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应
难度: 困难查看答案及解析
-
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
操作 现象 结论
A 滴加BaCl2溶液 生成白色沉淀 原溶液中有SO42-
B 滴加氯水和CCl4,振荡、静置 下层溶液显紫色 原溶液中有I-
C 用洁净铂丝蘸取溶液进行焰色反应 火焰呈黄色 原溶液中有Na+、无K+
D 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 试纸不变蓝 原溶液中无NH4+
难度: 中等查看答案及解析
-
某有机物H3C—CH=CH—COOH,不能发生的反应类型
A.氧化反应 B.加成反应 C.酯化反应 D.水解反应
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是其电子层数的3倍。下列说法正确的是
A.元素W的最高价氧化物对应水化物的酸性最强
B.单核阴离子半径的大小顺序为:r(W)>r(Y)>r(Z)
C.元素Y和元素Z的氢化物中均只存在极性共价键
D.元素Y和元素Z的最高正化合价相同
难度: 困难查看答案及解析
-
已知:①向KClO3晶体中滴加浓盐酸,产生黄绿色气体。②向NaI溶液中通入少量实验①产生的气体,溶液变黄色。③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是
A.实验①证明Cl-具有还原性
B.实验②中氧化剂与还原剂的物质的量之比为2∶1
C.实验③说明KI被氧化
D.上述实验证明氧化性:ClO3- > Cl2 > I2
难度: 中等查看答案及解析
-
下图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液。已知放电时电池反应为:Pb + PbO2 + 4H++ 2SO42—=2PbSO4 + 2H2O,下列有关说法正确的是
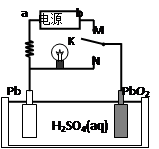
A.K与N相接时,能量由电能转化为化学能
B.K与N相接时,H+向负极区迁移
C.K与M连接时,所用电源的a极为负极
D.K与M相接时,阳极附近的pH逐渐减小
难度: 困难查看答案及解析
-
下列实验装置设计正确、且能达到目的的是
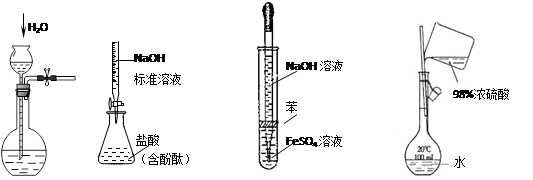
Ⅰ Ⅱ Ⅲ Ⅳ
A.实验I: 检查装置的气密性
B.实验II:测定未知盐酸的浓度
C.实验III:制取并观察Fe(OH)2沉淀
D.实验IV:配置一定的物质的量浓度的稀硫酸溶液
难度: 中等查看答案及解析
-
下列各溶液中,微粒的物质的量浓度关系正确的是
A.常温下,将pH=2的盐酸和pH=12的氨水等体积混合后:
c(NH4+)>c(Cl-)> c(OH-)>c(H+)
B.0.1 mol·L-1 Na2CO3溶液:c(Na+)=2c(HCO3-)+2c(CO32¯)+2c(H2CO3)
C.0.1 mol·L-1 NH4Cl溶液:c(NH4+)=c( Cl-)
D.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
难度: 困难查看答案及解析