-
下列各组中属于同位素的是
A.40K与40Ca B.35Cl2和37Cl2 C.D与T D.金刚石与石墨
难度: 简单查看答案及解析
-
对于放热反应2H2+O2====2H2O,下列说法正确的是
A.产物H2O所具有的总能量高于反应物H2和O2所具有的总能量
B.反应物H2和O2所具有的总能量高于产物H2O所具有的总能量
C.反应物H2和O2所具有的总能量等于产物H2O所具有的总能量
D.反应物H2和O2具有的能量相等
难度: 简单查看答案及解析
-
下列反应不可用于设计原电池的是
A.NaOH+HCl = NaCl+H2O
B.2CH3OH+3O2
2CO2+4H2O
C.Zn+2HCl = ZnCl2+H2↑
D.4Al+3O2+6H2O = 4Al(OH)3
难度: 简单查看答案及解析
-
X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X和Y组成原电池时,Y为电池的负极。X、Y、Z三种金属的活动性顺序为
A.X>Y>Z B.X>Z>Y C.Y>X>Z D.Y>Z>X
难度: 简单查看答案及解析
-
下列化合物中,阳离子半径与阴离子半径比值最小的是
A.NaF B.NaCl C.MgI2 D.KBr
难度: 简单查看答案及解析
-
把下列物质分别加入盛水的锥形瓶内,立即塞紧带U形管的塞子。已知U形管内预先装有少量水且液面相平(为便于观察,预先染 成红色),加入下列哪些物质后,发生如图所示变化: ①NaOH粉末; ②浓H2SO4;③NH4NO3晶体; ④Na2O2固体;⑤生石灰
A.①②④⑤ B.①②③ C.②③⑤ D.③④⑤
难度: 简单查看答案及解析
-
在N2 + 3H2
2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6
,在此时间内用NH3表示的反应速率为0.30
·S-1。则此一段时间是:( )
A.1秒 B.2秒 C.0.44秒 D.1.33秒
难度: 简单查看答案及解析
-
下列说法中,不正确的是
A.双原子分子中的共价键,一定是非极性键
B.非极性键也可能存在于离子化合物中
C.分子间作用力,又叫范德华力,它比化学键要弱得多
D.共价化合物在液态时不能导电
难度: 简单查看答案及解析
-
已知短周期元素的离子aA2+、bB+、cC2-、dD-都具有相同的电子层结构,则下列叙述正确的是
A.原子半径: A>B>D>C B.原子序数: d>c>b>a
C.离子半径: C>D>B>A D.单质的还原性: A>B>D>C
难度: 简单查看答案及解析
-
已知同周期X、Y、Z三种元素的最高价氧化物对应水化物酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则下列判断中正确的
A.单质的氧化性按X、Y、Z的顺序增强
B.阴离子的还原性按X、Y、Z的顺序减弱
C.气态氢化物的稳定性按X、Y、Z的顺序增强
D.元素非金属性按X、Y、Z的顺序减弱
难度: 简单查看答案及解析
-
国际化学组织已将周期表中原主、副族的族号去掉而改称列,如碱金属为第
1列,稀有气体为第18列。按此规定,下列叙述正确的是
A.第1列元素均能形成M2O和M2O2型化合物
B.第14列元素所形成的化合物种类最多
C.第17列元素均有最高价氧化物R2O7
D.最外层有两个电子的原子都在第2列
难度: 简单查看答案及解析
-
某种元素R的核外电子数等于核内中子数,取该元素5.6g跟氧气充分反应,可得到12g化合物RO2,则该种元素R在周期表中的位置是
A.第二周期第ⅣA族 B.第三周期第ⅣA族
C.第三周期第ⅥA族 D.第二周期第ⅥA族
难度: 简单查看答案及解析
-
已知:①能量越低的物质越稳定,②白磷转化成红磷放出热量。
据此,下列判 断或说法中正确的是
A.在相同的条件下,红磷比白磷稳定
B.在相同的条件下,白磷比红磷稳定
C.红磷和白磷的结构相同
D.红磷容易发生自燃而白磷则不会自燃
难度: 简单查看答案及解析
-
将锌片和铜片用导线连接后放入稀硫酸溶液中,发生原电池反应,
下列叙述错误的是
A.溶液的pH增大 B.溶液中的Zn2+浓度增大
C.溶液中的SO42-浓度增大 D.溶液的密度增大
难度: 简单查看答案及解析
-
已知空气—锌电池的电极反应为
锌片:Zn+2OH--2e-=ZnO+H2O 石墨:O2+2H2O+4e-=4OH-
根据此判断,锌片是
A.负极,并被氧化 B.负极,并被还原
C.正极,并被氧化 D.正极,并被还原
难度: 简单查看答案及解析
-
在反应:C+CO2
2CO中,可使反应速率增大的措施是
①增大压强 ②升高温度 ③通入CO2 ④增加碳的量 ⑤降低压强
A.①②③④ B.②③④⑤ C.①②③ D.②③④
难度: 简单查看答案及解析
-
镍氢电池的总反应式是 H2+2NiO(OH)
2Ni(OH)2,根据此反应式判断,此电池放电时,负极上发生反应的物质是
A.NiO(OH) B.Ni(OH)2 C.H2 D.H2和NiO(OH)
难度: 简单查看答案及解析
-
氢氧燃料电池是一种高效、环境友好的发电装置,它是以铂作电极,KOH溶液作电解液,总反应为:2H2 + O2 = 2H2O,正极反应为:O2 + 2H2O + 4e- = 4OH- 下列叙述不正确的是
A.H2通入负极区 B.O2通入正极区
C.负极发生氧化反应 D.正极发生氧化反应
难度: 简单查看答案及解析
-
可逆反应达到平衡的重要特征是( )。
A.反应停止了 B.正、逆反应的速率均为零
C.正、逆反应都还在继续进行 D.正、逆反应的速率相等
难度: 简单查看答案及解析
-
反应 A(g) + 3B(g) =" 2C(g)" + 2D(g) 在不同情况下测得化学反应速率,其中最快的是( )。
A.υ(D) =" 0.4" mol/(L·S) B. υ(B) =" 0.6" mol/(L·S)
C.υ(C) =" 0.5" mol/(L·S) D. υ(A) =" 0.15" mol/(L·S)
难度: 简单查看答案及解析
-
下列化合物的电子式书写正确的是

难度: 简单查看答案及解析
-
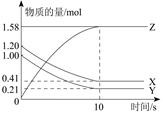
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化 的曲线如下图所示:下列描述正确的是

A.反应开始到10 s,用Z表示的反应速率为0.158 mol/(L?s)
B.反应开始到10 s,X的物质的量浓度减少了0.79 mol/L
C.反应开始到10 s时,Y的转化率为79.0 %
D.反应的化学方程式为:X(g)+Y(g)=Z(g)
难度: 简单查看答案及解析
-
可逆反应2SO2+O2
2SO3达到平衡的标志是
①消耗2 mol SO2的同时生成2 mol SO3
②SO2、O2与SO3的物质的量之比为2∶1∶2
③反应混合物中,SO3的质量分数不再改变
A.①② B.①③ C.只有③ D.全部
难度: 简单查看答案及解析
-
图是可逆反应X2 + 3Y2
2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是

A.t1时,只有正方向反应
B.t2时,反应未到达限度
C.t2- t3,反应不再发生
D.t2- t3,各物质的浓度不再发生变化
难度: 简单查看答案及解析
-
已知可逆反应2SO2+O2
2SO3是放热反应,下列说法正确的是
A.2molSO2 与1molO2 能完全反应生成2molSO3 ,升高温度可以加快此反应的化学反应速率
B.2molSO2 与1molO2不能完全反应生成2molSO3,升高温度可以加快此反应的化学反应速率
C.2molSO2 与1molO2 能完全反应生成2molSO3 ,升高温度减慢此反应的化学反应速率
D.2molSO2 与1molO2 不能完全反应生成2molSO3 ,升高温度减慢此反应的化学反应速率
难度: 简单查看答案及解析