-
下列化学反应的△H >O是( )
A.
(l)
B.
══
C.
══
D.
══
难度: 简单查看答案及解析
-
下列说法中有明显错误的是( )
A、对有气体参加的反应,增大压强,体系体积减小,可使单位体积内活化分子数增加,反应速率增大
B、活化分子之间发生的碰撞一定为有效碰撞
C、升高温度,一般可使活化分子的百分数增大,因而反应速率增大
D、加入适宜的催化剂,可使活化分子的百分数大大增加,从而增大反应速率
难度: 中等查看答案及解析
-
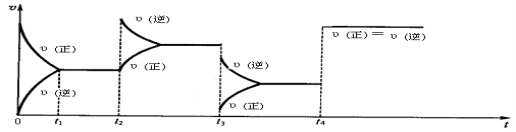
在2A(g)+B(g)
3C(g)+4D(g)中,表示该反应速率最快的是( )
A.υ(A)=0.5 mol/(L•s) B.υ(B)=0.3 mol/(L•s)
C.υ(C)=0.8 mol/(L•s) D.υ(D)=60 mol/(L•min)
难度: 中等查看答案及解析
-
下面是一段关于酸碱中和实验操作的叙述:①取一锥形瓶,用待测NaOH溶液润洗两次。②在一锥形瓶中加入25 mL待测NaOH溶液。③加入几滴石蕊试剂做指示剂。④取一支酸式滴定管,洗涤干净。⑤直接往酸式滴定管中注入标准酸溶液,进行滴定。⑥左手旋转滴定管的玻璃活塞,右手不停摇动锥形瓶。⑦两眼注视着滴定管内盐酸溶液液面下降,直至滴定终点。文中所述操作有错误的序号为( )
A.④⑥⑦ B.①⑤⑥⑦ C.③⑤⑦ D.①③⑤⑦
难度: 中等查看答案及解析
-
下列热化学方程式中的反应热又为燃烧热的是( )
A.
══
B.
══
C.
══
D.
══
难度: 简单查看答案及解析
-
“绿色化学”是当今社会提出的一个新概念.在“绿色化学工艺”中,理想状态是反应中原子全部转化为欲制得产物,即原子的利用率为100%.在用丙炔合成甲基丙烯酸甲酯
的过程中,欲使原子的利用率达到最高,在催化剂作用下还需要其他的反应物是( )
A.CO和CH3OH B.CO2和H2O C.CH2=CH2和CO D.CH3OH和H2
难度: 简单查看答案及解析
-
与实际化工生产流程相符的叙述是 ( )
A.制备硝酸的工业中,理论上氨中的氮元素100%转化为了硝酸
B.制备硫酸的工业尾气用氢氧化钠溶液吸收
C.让Cl2在H2中燃烧制氯化氢,将氯化氢气体通入水中获得盐酸
D.工业上用电解熔融氧化铝和冰晶石的混合物的方法得到铝
难度: 简单查看答案及解析
-
右图是某条件下
与
反应过程中能量变化的曲线图。根据图像判断下列叙述中正确的是( )
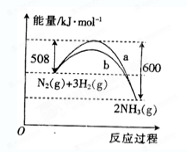
A.该反应的热化学方程式为
B.
曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热数值会减小
D.反应
难度: 中等查看答案及解析
-
已知反应:①2Na(s)+1/2O2(g)=Na2O(s) △H1=-414kJ/mol ②2Na(s)+O2(g)=Na2O2(s) △H2=-511kJ/mol
下列说法正确的是 ( )
A.①和②产物的阴阳离子个数比不相等
B.①和②生成等物质的量的产物时,转移电子数不同
C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.反应:Na2O2(s)+2 Na(s)= 2Na2O(s) △H=-317kJ/mol
难度: 困难查看答案及解析
-
对可逆反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g),下列叙述正确的是()
A.化学反应速率关系是:2v正(NH3)=3v正(H2O)
B.若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.达到化学平衡时,4v正(O2)=5v逆(NO)
难度: 中等查看答案及解析
-
某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)
Z(g)+W(s)ΔH>0,下列叙述正确的是( )
A.加入少量W,逆反应速率增大
B.升高温度,正反应速率增大,逆反应速率减小,平衡正向移动。
C.当容器中气体压强不变时,反应达到平衡
D.平衡后加入X,上述反应的ΔH增大
难度: 中等查看答案及解析
-
下列说法或表示方法中正确的是( )
A.相同条件下,等质量的硫蒸气和硫固体分别完全燃烧,反应的热效应ΔH1>ΔH2
B.由C(石墨)→C(金刚石)ΔH=+1.9kJ/mol,可知金刚石比石墨稳定
C.已知在101KPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量。则有关氢气燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O(l)ΔH=+285.8kJ/mol
D.在稀溶液中,H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ/mol,若将含0.5mol硫酸的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ
难度: 中等查看答案及解析
-
对于可逆反应2AB 3(g)
2A(g)+3B 2(g) △H>0 下列图象不正确的是( )

难度: 困难查看答案及解析
-
在298K、1.01×105 Pa下,将22g CO2缓慢通入750mL 1 mol•L-1NaOH溶液中充分反应后,测得反应放热为x kJ.已知该条件下,1mol CO2缓慢通入1L 2 mol•L-1NaOH溶液中充分反应后放热为y kJ.则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是( )
A.CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(2y-x)kJ•mol-1
B.CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(2x-y)kJ•mol-1
C.CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(4x-y)kJ•mol-1
D.2CO2(g)+2NaOH(aq)=2NaHCO3(aq) △H=-(8x-y)kJ•mol-1
难度: 困难查看答案及解析
-
在一密闭容器中,反应aA(g)
bB(g),达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡后,B的浓度是原平衡的60%,则( )
A.平衡向正反应方向移动了 B.物质A的转化率减少了
C.物质B的质量分数减小了 D. a > b
难度: 中等查看答案及解析
-
将 4mol A气体和2mol B气体在2L 固定体积的容器中混合并在一定条件下发生如下反应:
2A(g)+B(g)
2C(g).若经2s后测得 C 的浓度为 0.6 mol•L-1,现有下列几种说法,其中正确的是( )
A. 用物质A表示的反应的平均速率为0.2 mol•L-1•s-1
C. 2s时物质A的转化率为70%
B. 用物质B表示的反应的平均速率为0.1 mol•L-1•s-1
D. 2s时物质B的浓度为0.7 mol•L-1
难度: 中等查看答案及解析
-
向某密闭容器中充入1molCO和2molH2O(g),发生反应:CO+H2O (g)
CO2 +H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
A.0.5molCO+2molH2O(g)+1molCO2+1molH
B.1molCO+1molH2O(g)+1molCO2+1molH2
C.0.5molCO+1.5molH2O(g)+0.4molCO2+0.4molH2
D.0.5molCO+1.5molH2O(g)+0.5molCO2+0.5molH2
难度: 困难查看答案及解析
-
已知一定温度下,X(g)+2Y(g)
mZ(g);△H=-akJ/mol(a>0),现有甲、乙两容积相等且固定的密闭容器,在保持该温度下,向密闭容器甲中通入1molX和2molY,达到平衡状态时,放出热量bkJ;向密闭容器乙中通入2molX和4molY,达到平衡状态时,放出热量ckJ,且2b<c,则下列各值关系正确的是( )
A. a=b B. 2a<c C. m>3 D. m<3
难度: 中等查看答案及解析