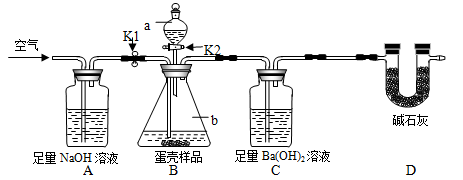
-
下列现象中,一定发生化学变化的是
A. 瓷碗破碎
 B. 铁丝弯曲
B. 铁丝弯曲
C. 蜡烛燃烧
 D. 冰雪融化
D. 冰雪融化
难度: 简单查看答案及解析
-
为保护我市优美的环境,促进经济可持续全面发展,你认为可向市政府提出的建议是
A. 大力发展燃油汽车的数量,提高城市现代化程度
B. 加快烟草事业的发展,增加国家的税收
C. 采用“绿色化学”工艺,使工业原料尽可能转化为所需要的物质
D. 推广使用卫生的一次性发泡塑料餐具,方便居民生活
难度: 简单查看答案及解析
-
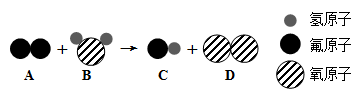
工业上生产硫酸的第一步反应为: 4X+11O2
2Fe2O3+8SO2,则X为
A. Fe2S3 B. FeS2 C. FeSO4 D. FeS
难度: 简单查看答案及解析
-
下图食物中糖类含量最高的是
A. 肥肉
 B. 山芋
B. 山芋
C. 青椒
 D. 鸡蛋
D. 鸡蛋
难度: 简单查看答案及解析
-
下列物质俗名与化学式相对应的是
A. 纯碱—NaOH B. 酒精—C2H6O C. 小苏打—Na2CO3 D. 生石灰—Ca(OH)2
难度: 简单查看答案及解析
-
刚腌制的咸菜里含有较多的亚硝酸钠(NaNO2)危害人体健康,亚硝酸钠中氮元素的化合价为
A. +5 B. -3 C. +3 D. +2
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 误食重金属盐,可服牛奶或鸡蛋清解毒
B. 水中Ca2+、Mg2+的增多会促进人体健康
C. 米饭遇到大量加碘食盐不会逐渐出现蓝色
D. 羊毛在空气中灼烧产生烧焦羽毛的气味
难度: 中等查看答案及解析
-
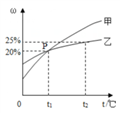
向一定量Ba(OH)2的溶液中加入稀H2SO4溶液,与反应有关的变化关系用下图表示,其中错误的是
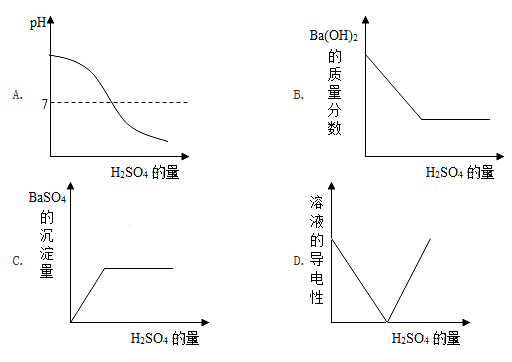
A. A B. B C. C D. D
难度: 极难查看答案及解析
-
将10.0%的NaOH溶液逐滴加入到50 g稀盐酸中,得到混合液的温度与加入NaOH溶液的质量关系如图。下列说法正确的是

A. a点时的混合液能与Fe发生置换反应
B. b点时的混合液能与Mg(NO3)2发生两种复分解反应
C. 加入40 g NaOH溶液时混合液pH>7
D. 稀盐酸中HCl的质量分数为3.65%
难度: 极难查看答案及解析
-
下列说法正确的是
A. 用pH试纸测得某雨水的pH为4.1,则可判定该雨水一定为酸雨
B. 钠能与硫酸铜溶液发生反应,生成铜和硫酸钠
C. 有盐和水生产的反应不一定是中和反应
D. 向某溶液中滴入无色酚酞,溶液变红色,则该溶液一定为碱溶液
难度: 困难查看答案及解析
-
要将铜粉中混有的少量铁粉除去,以下实验步骤和实验操作有错误的是
A
B
C
D
实验步骤
加入过量稀盐酸
搅拌
过滤
蒸发结晶
实验操作




A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列是分析放置在空气中的NaOH固体的相关实验,其中合理的是
序号
实验目的
实验方案
A
证明变质
取少量固体,加水溶解,滴加少量稀盐酸,观察是否有气泡产生
B
确定成分
取少量固体,加入石灰水,过滤,向滤液中滴加酚酞溶液
C
测定含量
取少量固体,加入足量稀盐酸,直接用排水法收集VmL气体
D
除去杂质
取固体,加水溶解,滴加石灰水至恰好完全反应,过滤
A. A B. B C. C D. D
难度: 极难查看答案及解析
-
现有一包含K2CO3和CaCO3的混合粉末75g,向其中加入一定量某浓度的稀盐酸,恰好反应后将滤液蒸干,得到82.7g固体(不带结晶水),则原混合粉末中的金属元素的质量分数是
A. 46% B. 44% C. 50% D. 55%
难度: 极难查看答案及解析