-
化学与生活密切相关,下列说法正确的是
A. 铝制容器不宜长时间存放酸性食物、碱性食物以及含盐腌制食物
B. 生活中常用热的小苏打除油污,利用的是水解反应吸热的特点
C. Mg可通过电解MgCl2的水溶液来制取,Al可通过电解熔融的Al2O3来制取
D. 用来煎炸食物的花生油和牛油都是可以发生皂化反应的饱和脂肪酸甘油酯
难度: 简单查看答案及解析
-
下列实验操作、实验现象以及所得出的结论均正确的是
选项
实验操作
实验现象
结论
A
向1mL2mol/LNaOH溶液中先滴加2滴0.1mol/LMgCl2溶液,再滴加2滴0.1mol/LFeCl3溶液
先生成白色沉淀,后生成红褐色沉淀
Ksp[Fe(OH)3] <Ksp[Mg(OH)2]
B
向NH3·H2O溶液中滴加少量AgNO3溶液
无明显现象
NH3·H2O 和AgNO3不 反 应
C
将木炭和浓硫酸共热生成的气体通入澄清石灰水中
澄清石灰水变浑浊
该气体只含CO2
D
向某溶液中加入盐酸酸化的BaCl2溶液
有白色沉淀产生
该溶液中可能含有SO42-
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
设NA 为阿伏加德罗常数的数值。下列叙述正确的是
A. 13.8gNO2与足量水反应,转移的电子数为0.2 NA
B. 1molOH-与17gNH3所含的电子数分别为9NA 和10 NA
C. 常温常压下,0.1mol NH3与0.1mol HCl 充分反应后所得的产物中含有的分子数为0.1 NA
D. 1mol AlCl3在熔融状态时含有的离子总数为0.4 NA
难度: 中等查看答案及解析
-
锂碘电池的正极材料是聚2-乙烯吡啶(简写为P2VP)和I2 的复合物,电解质是熔融薄膜状的碘化锂,正极的电极反应式为P2VP·nI2+2e-+2Li+=P2VP·(n- 1)I2+2LiI。下列说法正确的是
A. 该电池放电时,锂电极发生还原反应
B. P2VP和I2的复合物是绝缘体,不能导电
C. 该电池发生的总反应为2Li+P2VP·nI2=P2VP·(n-1)I2+2LiI
D. 该电池工作时,碘离子移向正极
难度: 中等查看答案及解析
-
增塑剂DCHP可由环已醇制得。环已醇和DCHP的结构简式如图所示,下列说法正确的是

A. DCHP的分子式为C20H14O4
B. 环已醇和DCHP的二氯代物均有4种
C. 1mol DCHP 水解时消耗2 mol NaOH
D. 环己醇分子中的所有碳原子可能共平面
难度: 中等查看答案及解析
-
X、Y、Z、W 为原子序数依次增大的四种短周期主族元素,其中X、Z同主族,Y原子的最外层电子数为次外层电子数的一半,X原子的最外层电子数是其核外电子层数的3倍。下列说法不正确的是
A. 最简单气态氢化物的热稳定性:W>Z> Y B. 单质的沸点:Y>X>Z
C. 简单离子半径:Z>W>X D. X 的氢化物中可能含有非极性共价键
难度: 中等查看答案及解析
-
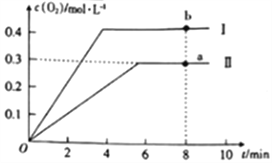
常温下,向10mL 0.2mol/L草酸溶液中逐滴加入等浓度的NaOH溶液,溶液中各微粒的物质的量与混合溶液pH的关系如图所示,下列说法正确的是
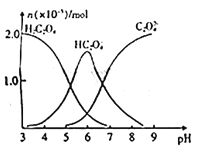
A. 当V(NaOH溶液)< 10mL时,溶液中可能存在:c(Na+)=2c(C2O42-)+c(HC2O4-)
B. 当V(NaOH溶液)=10mL时,溶液中水的电离程度比纯水大
C. 当V(NaOH溶液) =15 mL时,溶液中存在: c(Na+)>c(HC2O4-)>c(C2O42-)
D. 当V(NaOH溶液)=20mL时,溶液中存在:c(OH-) =2c(H2C2O4)+c(H+)+c(HC2O4-)
难度: 中等查看答案及解析
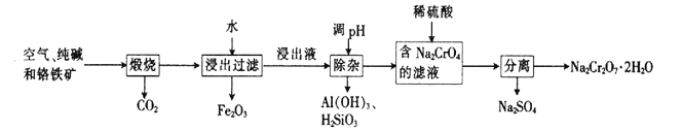
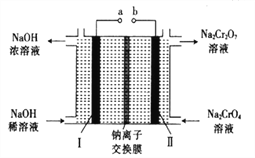

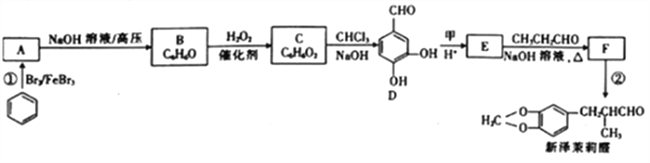
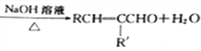
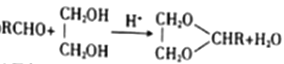
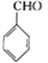 为原料(无机试剂任选)制备
为原料(无机试剂任选)制备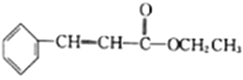 的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________。
的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________。