-
用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为V1和V2,则V1和V2的关系正确的是( )
A.V1>V2
B.V1<V2
C.V1=V2
D.V1≤V2难度: 中等查看答案及解析
-
在5mL 0.1mol/L KI溶液中滴加0.1mol/L FeCl3溶液5~6滴后,生成Fe2+和I2,再进行下列实验,其中可证明FeCl3溶液和KI溶液的反应是可逆反应的实验是( )
A.再滴加AgNO3溶液,观察是否有AgI沉淀产生
B.加入CCl4振荡后,观察下层液体颜色
C.加入CCl4振荡后,取上层清液,滴加AgNO3溶液,观察是否有AgCl沉淀产生
D.加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察是否有血红色难度: 中等查看答案及解析
-
下列实验结论,其中错误的是( )
A.往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘
B.当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据
C.制备硫酸亚铁铵晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液表面出现晶膜为止,不能将溶液全部蒸干
D.提取海带中碘元素时,为保证I-完全氧化为I2,加入的氧化剂(H2O2或新制氯水)均应过量难度: 中等查看答案及解析
-
化学与生活、社会密切相关.下列说法不正确的是( )
A.我国规定商家不得无偿提供塑料袋,目的是减少“白色污染”
B.三聚氰胺(cyanuramide,分子式C3H6N6)含氮量很高,可作为饲料添加剂
C.化石燃料不可再生,使用太阳能代替化石燃料,有利于节约资源、保护环境
D.腌制食品中严格控制NaNO2的用量难度: 中等查看答案及解析
-
0.5mol氯离子( )
A.质量为35.5g
B.含17mol质子
C.含9mol电子
D.含8mol最外层电子难度: 中等查看答案及解析
-
某化验室对一样品溶液进行分析,经煮沸后初步检查溶液呈强酸性,在下列离子中,能够大量存在的是( )
A.S2-
B.
C.
D.CH3COO-难度: 中等查看答案及解析
-
下列说法正确的是( )
A.欲除去KNO3晶体中的少量NaCl杂质,可先将样品溶解,再用蒸发结晶的方法除去杂质
B.容量瓶和中和滴定用的锥形瓶用蒸馏水洗净后便可立即使用,而不会对实验结果造成误差
C.用砂纸打磨过的铝箔放在灯焰上不燃烧,说明铝不易与O2反应
D.在层析操作时,要让试样点刚好接触展开剂,否则不能很好的分离难度: 中等查看答案及解析
-
在0.1mol•L-1Al2(SO4)3溶液中,下列关系式正确的是( )
A.c(H+)<c(OH-)<c(Al3+)<c(SO42-)
B.c(OH-)<c(H+)<c(Al3+)<c(SO42-)
C.c(H+)+c(Al3+)=0.2mol/L
D.c(H+)+c(Al3+)═c(SO42-)+c(OH-)难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A.SiO2和CO2都是共价化合物
B.根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
C.2g氦气所含原子数为NA
D.CH4的摩尔质量为16g难度: 中等查看答案及解析
-
以下说法中正确的是( )
A.△H<0的反应均是自发反应
B.△S为负值的反应均不能自发进行
C.冰在室温下自动熔化成水,是熵增的重要结果
D.高锰酸钾加热分解是一个熵减小的过程难度: 中等查看答案及解析
-
下列各项所述的两个量,前者一定大于(或高于)后者的是( )
A.Cl2和Br2的沸点
B.H-和H+的离子半径
C.同温下分别在100g水中最多能溶解的无水CuSO4的质量和CuSO4•5H2O的质量
D.在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数难度: 中等查看答案及解析
-
常温下,溶液中可发生以下反应:①2M2++R2═2M3++2R-,②2R-+Z2=R2+2Z-,③W2+2Z-═2W-+Z2;由此判断下列说法错误的是( )
A.常温下反应2M2++Z2═2M3++2Z-可以自发进行
B.Z元素在反应②中被还原,在③中被氧化
C.氧化性强弱顺序为:W2<Z2<R2<M3+
D.还原性强弱顺序为:W-<Z-<R-<M2+难度: 中等查看答案及解析
-
已知反应10AgF+5Cl2+5H2O═9AgCl+AgClO3+10HF+O2,则有1molO2生成时反应所转移的电子总数为( )
A.4mol
B.9mol
C.10mol
D.5mol难度: 中等查看答案及解析
-
下列说法正确的是( )
A.ⅦA族元素的非金属性一定比ⅥA族元素的非金属性强
B.第三周期元素的阳离子半径从左到右逐渐减小
C.ⅥA族元素的氢化物中,因为H2O的沸点最高,所以其稳定性也最好
D.同周期非金属氧化物对应的水化物的酸性从左到右依次增强难度: 中等查看答案及解析
-
以下物质间的转化中,其中有不能通过一步反应实现的是( )
A.Al-Al2O3-Al(OH)3-NaAlO2
B.Fe-FeCl2-Fe(OH)2-Fe(OH)3
C.S-SO2-H2SO4-MgSO4
D.N2-NO-NO2-HNO3难度: 中等查看答案及解析
-
以多孔铂为电极,在如图装置中分别在两极区通入CH3OH和O2,发生反应产生电流,经测定,电流方向由b到a,下列叙述中正确的是( )
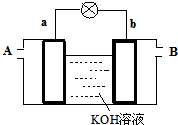
A.A处通入O2
B.溶液中的阳离子向a极运动
C.负极的电极反应为:2CH3OH+16OH--12e-═2CO32-+12H2O
D.b极是该燃料电池的负极难度: 中等查看答案及解析
-
强电解质Ag2CrO4的溶解度是0.0216g•L-1,则其浓度积Ksp为( )
A.0.0216
B.
C.0.02162×0.0216
D.难度: 中等查看答案及解析
-
向足量H2SO4溶液中加入100mL 0.4mol•L-1 Ba(OH)2溶液,放出的热量是5.12kJ.如果向足量Ba(OH)2溶液中加入100mL 0.4mol•L-1 HCl溶液时,放出的热量为2.2kJ.则Na2SO4溶液与BaCl2溶液反应的热化学方程式为( )
A.Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-2.92kJ•mol-1
B.Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-0.72kJ•mol-1
C.Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-73kJ•mol-1
D.Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-18kJ•mol-1难度: 中等查看答案及解析