-
X、Y、Z、W为原子序数依次增大的短周期主族元素,X是最外层只有一个电子的非金属元素,Y是地壳中含量最高的元素,W的原子序数是Y的2倍, X、Y、Z、W的最外层电子数之和为15。下列说法正确的是
A. X和Y只能形成一种化合物 B. 简单离子半径:W2->Y2->Z2+
C. 简单气态氢化物的热稳定性:W>Y D. WY2、ZY中化学键类型相同
难度: 中等查看答案及解析
-
化学与环境保护、社会可持续发展密切相关,下列做法合理的是
A. 进口国外电子垃圾,回收其中的贵重金属
B. 将地沟油回收加工为生物柴油,提高资源的利用率
C. 大量生产超薄塑料袋,方便人们的日常生活
D. 洗衣粉中添加三聚磷酸钠,增强去污的效果
难度: 中等查看答案及解析
-
下列化学用语表达正确的是
A. Al3+的结构示意图:
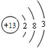 B. Na2O2的电子式:
B. Na2O2的电子式:C. 淀粉的分子式:(C6Hl2O6)n D. 质量数为37的氯原子:
Cl
难度: 简单查看答案及解析
-
下列过程属于化学变化的是
A. 焰色反应 B. 石油分馏 C. 煤的干馏 D. 碘的升华
难度: 简单查看答案及解析
-
下列物质与其主要成分的化学式相对应的是
A. 铝热剂-A1 B. 酒精-CH3COOH C. 纯碱一Na2CO3 D. 葡萄糖-C12H22O11
难度: 简单查看答案及解析
-
下列关于糖类、油脂、蛋白质的说法正确的是
A. 葡萄糖溶液中加入新制Cu(OH)2悬浊液煮沸会析出砖红色沉淀
B. 油脂水解可得到氨基酸和甘油
C. 蔗糖在人体内水解产物只有葡萄糖
D. 纤维素和淀粉互为同分异构体
难度: 简单查看答案及解析
-
实验室由海水获得淡水的实验装置是

A. B. C. D.
难度: 简单查看答案及解析
-
下列物质属于共价化合物的是
A. CaO B. CO2 C. C60 D. NaCl
难度: 简单查看答案及解析
-
反应2SO2+O2
2SO3在密闭容器中进行。下列关于该反应的说法错误的是
A. 升高温度能加快反应速率 B. 使用恰当的催化剂能加快反应速率
C. 增大O2的浓度能加快反应速率 D. SO2与O2能100%转化为SO3
难度: 困难查看答案及解析
-
下列反应既是氧化还原反应,且在反应过程中能量的变化如下图所示的是
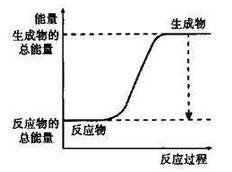
A. Mg+2HCl=MgCI2+H2↑
B. 2NH4Cl+Ba(OH)2•8H2O=BaCl2+2NH3↑+10H2O
C. H2SO4+2NaOH==Na2SO4+2H2O
D. C+CO2
2CO
难度: 简单查看答案及解析
-
下列有机反应属于加成反应的是
A. CH3CH3+Cl2光照CH3CH2Cl+HCl
B. CH2==CH2+HBr→CH3CH2Br
C. 2CH3CH2OH+O2
2CH3CHO+2H2O
D. CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
难度: 中等查看答案及解析
-
利用铝热反应原理焊接钢轨的化学方程式为Fe2O3+2Al
2Fe+Al2O3,关于该反应的叙述错误的是
A. 属于置换反应 B. A1作还原剂 C. Fe2O3被还原 D. 该反应是吸热反应
难度: 简单查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
A. 油脂能在碱性条件下水解,可用于工业上制取肥皂
B. 碘单质易溶于有机溶剂,可用酒精萃取碘水中的碘
C. 二氧化锰具有较强的氧化性,可用于H2O2分解的氧化剂
D. 聚氯乙烯膜具有塑性和弹性,可用作食品保鲜膜
难度: 中等查看答案及解析
-
互为同分异构体的一组物质是
A. 金刚石和石墨 B.
H和
H
C. CH3CH2OH和CH3OCH3 D. CH4和C2H6
难度: 简单查看答案及解析
-
下列物质的转化中,不能通过—步化学反应实现的是
A. Fe—Fe3O4 B. C2H2—CO2 C. CH2=CH2→CH3CH3 D. A12O3→Al(OH)3
难度: 中等查看答案及解析
-
下列说法错误的是
A. 通过加热分解HgO可制得单质Hg
B. 活泼金属Na、Mg、Al的冶炼通过电解其熔融状态的氧化物制得的
C. 沙里淘金是利用金和沙子的密度不同,从而将金粒分离出来
D. 高炉炼铁时,还原剂CO将铁从铁矿中还原出来
难度: 简单查看答案及解析
-
设NA为阿伏加徳罗常数的值,下列说法中正确的是
A. 标准状况下,22.4LCH4完全燃烧时转移电子数为8NA
B. 常温常压下,11.2L乙醇中含有的分子数为0.5NA
C. 78g苯含有的碳碳双键数目为3NA
D. 0.1mol·L-1NaCl溶液中含有Na+的数目为0.1NA
难度: 中等查看答案及解析
-
下列离子在溶液中可以大量共存的是
A. Na+、 NO3-、SO42- B. Ag+、NO3-、Cl-
C. H+、K+、CH3COO- D. NH4+、Na+、OH-
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 锌粒与稀醋酸反应:Zn+2H+=Zn2++H2↑
B. 碳酸镁跟硫酸反应:MgCO3+2H+=Mg2++H2O+CO2↑
C. 氯化镁溶液与氨水反应:Mg2++2OH-=Mg(OH)2↓
D. 氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
难度: 简单查看答案及解析
-
下列鉴别物质的方法能达到目的的是
A. 用氨水鉴别MgCl2溶液和AlCl3溶液
B. 用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液
C. 用KSCN溶液鉴别FeCl3溶液和FeCl2溶液
D. 用淀粉溶液鉴别加碘盐和未加碘盐(己知加碘盐中添加的是KIO3)
难度: 中等查看答案及解析
-
下列关于乙醇和乙酸的说法正确的是
A. 都难溶于水 B. 都能使紫色石蕊试液变红
C. 都能和CaCO3反应 D. 都能发生酯化反应
难度: 简单查看答案及解析
-
对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是( )
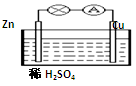
①Zn是负极 ②电子由Zn经外电路流向Cu
③Zn-2e-=Zn2+④溶液中H+向Zn棒迁移
A. ①② B. ①②③
C. ②③④ D. ①②③④
难度: 中等查看答案及解析
-
—定条件下,在容积为2L的密闭容器中发生反应:2A(g) + B(g)
2C(g),己知起始投入4molA(g)和2molB(g),经2s后测得C的浓度为0.6mol·L-1,并且2s后各组分浓度不再改变。下列说法正确的是
A. 2s内用物质A表示的平均反应速率为0.3mol • L-1·s-1
B. 2s内用物质B表示的平均反应速率为0.6 mol • L-1·s-1
C. 2s后每有0.6 mol的物质B生成,同时就有0.6 mol物质C生成
D. 2s时物质B的物质的量浓度为1.4mol • L-1
难度: 中等查看答案及解析