-
当镁原子由1s22s22p63s2 →1s22s22p63p2时,以下认识正确的是( )
A. 镁原子由基态转化成激发态,这一过程中吸收能量
B. 镁原子由激发态转化成基态,这一过程中释放能量
C. 转化后位于p能级上的两个电子处于同一轨道,且自旋方向相同
D. 转化后镁原子与硅原子电子层结构相同,化学性质相似
难度: 简单查看答案及解析
-
用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( )
A. 直线形;三角锥形 B. V形;三角锥形
C. 直线形;平面三角形 D. V形;平面三角形
难度: 中等查看答案及解析
-
下列晶体中,化学键种类相同,晶体类型也相同的是
A.SO2与SiO2 B.CO2与H2O C.NaCl与HCl D.CCl4与KCl
难度: 中等查看答案及解析
-
下面的排序不正确的是( )
A. 晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B. 硬度由大到小:金刚石>碳化硅>晶体硅
C. 熔点由高到低:Na>Mg>Al
D. 晶格能由大到小: NaF> NaCl> NaBr>NaI
难度: 中等查看答案及解析
-
根据等电子原理,等电子体之间结构相似、物理性质也相近.以下各组粒子不能互称为等电子体的是( )
A. CO和N2 B. O3和SO2 C. CO2和N2O D. N2H4和C2H4
难度: 中等查看答案及解析
-
氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,断裂1molH2中的化学键消耗的能量为Q1kJ,断裂1molCl2中的化学键消耗的能量为Q2kJ,形成1molHCl中的化学键释放的能量为Q3kJ。下列关系式中正确的是( )
A. Q1+Q2>Q3 B. Q1+Q2>2Q3 C. Q1+Q2<Q3 D. Q1+Q2<2Q3
难度: 中等查看答案及解析
-
在乙烯分子中有5个σ键、一个π键,它们分别是( )
A. sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B. sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C. C﹣H之间是sp2形成的σ键,C﹣C之间是未参加杂化的2p轨道形成的π键
D. C﹣C之间是sp2形成的σ键,C﹣H之间是未参加杂化的2p轨道形成的π键
难度: 中等查看答案及解析
-
下列反应中,既属于氧化还原反应同时又是吸热反应的是( )
A. Ba(OH)2.8H2O与NH4Cl反应
B. 铝与稀盐酸
C. 灼热的炭与CO2反应
D. 甲烷与O2的燃烧反应
难度: 简单查看答案及解析
-
下列物物质中,可证明某晶体是离子晶体的是 ( )
A.易溶于水 B.晶体不导电,熔化时能导电
C.熔点较高 D.晶体不导电,水溶液能导电
难度: 简单查看答案及解析
-
某单质晶体一定不是 ( )
A.离子晶体 B.分子晶体 C.原子晶体 D.金属晶体
难度: 简单查看答案及解析
-
下列各组中的两种固态物质熔化或升华时,克服的微粒间相互作用力属于同种类型的是 ( )
A. 碘和氯化钾 B. 金刚石和重晶石
C. 二氧化硅和干冰 D. 软脂酸甘油酯和冰醋酸
难度: 简单查看答案及解析
-
下列说法中正确的是
A. 物质发生化学反应时不一定都伴随着能量变化
B. 伴有能量变化的变化都是化学变化
C. 在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量
D. 在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同
难度: 简单查看答案及解析
-
下列分子或离子中,含有孤对电子的是( )
A. H2O B. CH4 C. SiH4 D. NH4+
难度: 中等查看答案及解析
-
下面的排序不正确的是( )
A. 晶体熔点的高低:
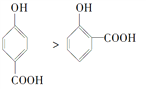
B. 熔点由高到低:Na>Mg>Al
C. 硬度由大到小:金刚石>碳化硅>晶体硅
D. 晶格能由大到小:NaF>NaCl>NaBr>NaI
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B. P4和CH4都是正四面体分子且键角都为109°28′
C. NaCl晶体中与每个Na+距离相等且最近的Na+共有8个
D. 单质的晶体中一定不存在的微粒是阴离子
难度: 中等查看答案及解析
-
下列表达方式错误的是
A.
B. 甲烷的电子式
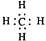
C. 硫离子的核外电子排布式 1s22s22p63s23p6 D. 碳-12原子构成
C
难度: 简单查看答案及解析
-
已知X.Y元素同周期,且电负性X>Y,下列说法错误的是( )
A. X与Y形成化合物时,X显负价,Y显正价
B. 第一电离能Y不一定大于X
C. 最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸性
D. 气态氢化物的稳定性:HmY小于HmX
难度: 困难查看答案及解析
-
下列热化学方程式中,△H能正确表示物质的燃烧热的是( )
A. CO(g) +1/2O2(g) ==CO2(g); △H=-283.0 kJ/mol
B. C(s) +1/2O2(g) ==CO(g); △H=-110.5 kJ/mol
C. H2(g) +1/2O2(g)==H2O(g); △H=-241.8 kJ/mol
D. 2C8H18(l) +25O2(g)==16CO2(g)+18H2O(l); △H=-11036 kJ/mol
难度: 简单查看答案及解析
-
已知X.Y.Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的是( )

A. ZXY3 B. ZX2Y6 C. ZX4Y8 D. ZX8Y12
难度: 中等查看答案及解析
-
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液,下列对此现象的说法正确的是( )
A. 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B. 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+
C. [Cu(NH3)4]2+的空间构型为正四面体型
D. 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道
难度: 中等查看答案及解析
-
下面是一些原子的2p能级和3d能级中电子排布的情况,其中正确的是
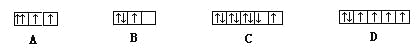
难度: 简单查看答案及解析
-
构造原理揭示的电子排布能级顺序,实质是各能级能量高低顺序.若以E表示某能级的能量,下列能量大小顺序中正确的是 ( )
A. E(3s)>E(3p)>E(3d) B. E(3s)>E(2s)>E(1s)
C. E(2f)>E(3d)>E(4s) D. E(5s)>E(4s)>E(4f)
难度: 简单查看答案及解析
-
有下列两组命题
A组
B组
Ⅰ.H—I键键能大于H—Cl键键能
①HI比HCI稳定
Ⅱ.H—I键键能小于H—C1键键能
②HCl比HI稳定
Ⅲ.HI分子间作用力小于HCl分子间作用力
③HI沸点比HCl高
Ⅳ.HI分子间作用力大于HCl分子间作用力
④HCl沸点比HI高
B组中命题正确,且能用A组命题加以正确解释的是 ( )
A. Ⅰ① B. Ⅱ② C. Ⅲ③ D. Ⅳ④
难度: 中等查看答案及解析