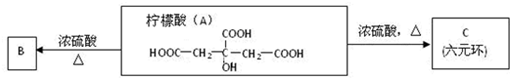
-
下列有关叙述中正确的是( )
A.几千万年前地球上一条恐龙体内的某个原子可能在你的身体里
B.用家用汽车代替公交车能达到节能减排的目的
C.以前的鸡毛信可以用碘水润湿阅读,说明信是由蛋白质溶液书写而成
D.淀粉的含量属于食品安全检测指标难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法不正确的是( )
A.1molα-氨基乙酸(甘氨酸)分子中存在10NA对共用电子
B.25℃时,l L pH=13的Ba(OH)2 溶液中含有Ba2+的数目为0.1NA
C.在一定条件下,46g的NO2和N2O4混合气体中原子数目为3NA
D.含有非极性键的数目为NA的Na2O2与水充分反应产生标况下O2约11.2L难度: 中等查看答案及解析
-
下列离子方程式不正确的( )
A.100mL0.1mol•L-1的Na2CO3溶液中加入0.01molCH3COOH CO32-+CH3COOH=HCO3-+CH3COO-
B.4mol•L-1的NaAlO2溶液和7mol•L-1的HCl等体积互相均匀混合4AlO2-+7H++H2O=3Al(OH)3↓+Al3+
C.在含有Mn2+的溶液中加入HNO3再加入PbO2,则反应体系显紫红色5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2H2O
D.甲醛溶液中加入足量的银氨溶液并加热HCHO+2[Ag (NH3)2]++2OH-HCOO-+NH4++2Ag↓+3NH3+H2O
难度: 中等查看答案及解析
-
关于元素周期表的叙述正确的是( )
A.所有主族元素都有最高正价,一定等于其所在的族序数
B.同周期的ⅡA、ⅢA元素的原子序数之差一定为1
C.每一周期都是从金属元素开始至稀有气体元素结束
D.同主族相邻周期的原子序数之差可能为8、18、32难度: 中等查看答案及解析
-
关于下列四个图象的说法中正确的是( )
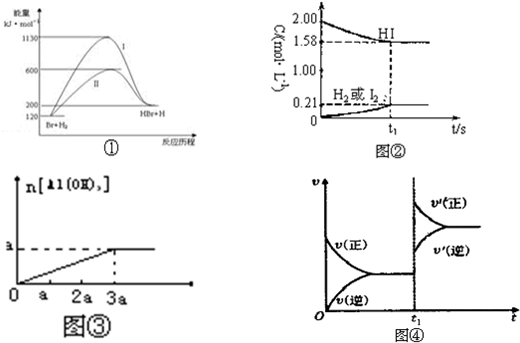
A.图①表示Br+H2→HBr+H反应热:过程I>过程Ⅱ
B.图②表示的反应是H2(g)+I2(g)⇌2HI(g)
C.图③可以表示在AlCl3溶液中不断加一定浓度的NaOH溶液时,生成Al(OH)3沉淀的情况
D.图④表示可逆反应H2(g)+I2(g)⇌2HI(g),△H>0,达到平衡后,升高温度时,速率改变的情况难度: 中等查看答案及解析
-
下面是三种常见治疗胃病药品的标签:

关于上述三种治疗胃病药品的叙述正确的是( )
A.每片药中和胃酸的量的相同
B.①中与胃酸反应的离子方程式为CO32-+2H+=CO2↑+H2O
C.胃穿孔病人不宜吃胃药①
D.胃药②易溶于水,溶液能使酚酞试液变红难度: 中等查看答案及解析
-
毒扁豆碱是用于催醒、治疗青光眼的药品,其键线式结构如图所示,关于毒扁豆碱的说法正确的是( )
A.毒扁豆碱的分子式为C15H19N3O2
B.在碱性条件下能稳定存在
C.该结构中至少有12个原子共面
D.1mol毒扁豆碱与H2反应可消耗4molH2难度: 中等查看答案及解析
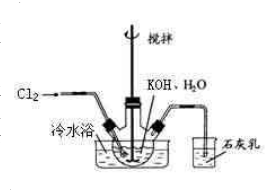 冷水浴冷却,通入Cl2,用电动搅拌器不断搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止.②将饱和次氯酸钾倒入烧杯并置于冷水浴中.在不断搅拌下,分几次加入130gKOH固体.用玻璃砂芯漏斗过滤,弃去残渣(主要成分为KCl和少量KOH、KClO),得次氯酸钾强碱性饱和溶液.
冷水浴冷却,通入Cl2,用电动搅拌器不断搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止.②将饱和次氯酸钾倒入烧杯并置于冷水浴中.在不断搅拌下,分几次加入130gKOH固体.用玻璃砂芯漏斗过滤,弃去残渣(主要成分为KCl和少量KOH、KClO),得次氯酸钾强碱性饱和溶液.