-
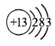
.下列有关化学用语使用正确的是
A.CO2的电子式:
B.中子数为20的氯原子:
C.乙烯的比例模型:
D.铝离子结构示意图:
难度: 简单查看答案及解析
-
.下列表示对应化学反应的离子方程式正确的是
A.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+= Cu2+ + 2Fe2+
B.AlCl3溶液中加入过量的浓氨水:Al3++4NH3·H2O =AlO2-+4NH4++2H2O
C.大理石溶于醋酸中的反应:CaCO3+2H+=Ca2++H2O+CO2↑
D.钠与水反应:Na + 2H2O = Na+ + 2OH- + H2↑
难度: 简单查看答案及解析
-
.下列粒子在相应条件下可大量共存的是
A.常温常压下混合气体:H2、F2、NO、O2
B.碱性溶液中:Na+、S2-、SO32-、CO32-
C.酸性溶液中:K+、Fe3+、SO32-、I-
D.含有0.1 mol·L-1 Ca2+的溶液中:Na+、Cu2+、SiO32-、NO3-
难度: 简单查看答案及解析
-
.NA代表阿伏加德罗常数的值,下列有关叙述正确的是
A.标准状况下,2.24LH2O含有的电子数等于NA
B.常温下,100mL 1mol·L-1Na2CO3溶液中阴离子总数小于0.1NA
C.标准状况下,分子数为NA的N2、C2H4混合气体体积约为22.4L,质量为28g
D.3.4gNH3中含N—H键数目为0.2NA
难度: 简单查看答案及解析
-
.下列关于化学键的说法正确的是
A.构成单质分子的微粒一定含有共价键
B.全部由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于双原子单质分子中
D.不同元素组成的多原子分子里的化学键一定都是极性键
难度: 简单查看答案及解析
-
.日本地震导致核电站泄露出大量的人工放射性核素,如131I(碘)、137Cs(铯)等。下列说法正确的是
A.放射性废水的处理方法主要有稀释排放法、放置衰变法、沥青固化法
B.127I是碘元素稳定的同位素,与131I互为同分异构体
C.127I与131I的质量数不同,核外电子排布方式也不同
D.铯为I A族元素,常温时,0.1mol·L-1的137CsOH溶液,pH<13
难度: 简单查看答案及解析
-
.物质的量浓度相同时,下列既能跟NaOH溶液反应,又能跟盐酸反应的溶液中,pH最大的是
A.Na2CO3溶液 B.NH4HCO3溶液 C.NaHCO3溶液 D.NaHSO4溶液
难度: 简单查看答案及解析
-
.下列实验现象与新制氯水中的某些成分(括号内物质)没有关系的是
A.将NaHCO3固体加入新制氯水,有无色气泡(H+)
B.使红色布条褪色(HClO)
C.滴加AgNO3溶液生成白色沉淀(Cl-)
D.向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈红色(HCl)
难度: 简单查看答案及解析
-
.下列说法正确的是
A.若发生A2+ 2D-=2A-+ D2反应,则氧化性D2>A2
B.若X原子的质子数是a,中子数是b,则该核素可表示为 baX
C.若相同温度和浓度的两种钠盐溶液的碱性NaA<NaB,则酸性HA>HB
D.若主族元素的简单离子R 2- 和M+的电子层结构相同,则原子序数R>M
难度: 简单查看答案及解析
-
.某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断中正确的是
A.肯定有SO2和NO B.可能有Cl2、O2和NO2
C.可能有Cl2和O2 D.肯定只有NO
难度: 简单查看答案及解析
-
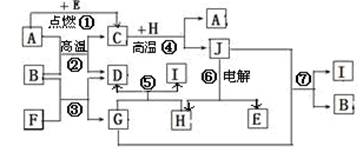
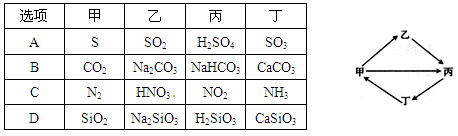
.下列各组物质按如图所示转化关系每一个转化都能一步实现的是
难度: 简单查看答案及解析
-
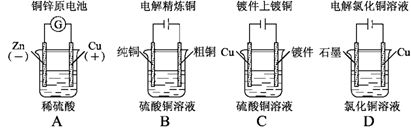
.下列图示中关于铜电极的连接错误的是
难度: 简单查看答案及解析
-
.短周期金属元素甲—戊在元素周期表中的相对位置如右表所示,下面判断正确的是
A.原子半径: 丙<丁<戊 B.金属性:甲>丙
C.最外层电子数:甲>乙 D.氢氧化物碱性:丙>丁>戊
难度: 简单查看答案及解析
-
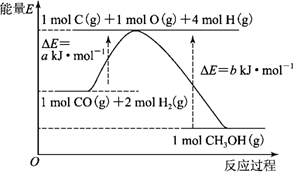
.已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
A.H2(g)的燃烧热为571.6 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.1/2H2SO4(aq)+1/2Ba(OH)2(aq)===1/2BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
难度: 简单查看答案及解析
-
将4mol A和2mol B放入2 L密闭容器中发生反应2A(g) + B(g)
2C(g) ΔH<0。
4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是
A.达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率增大,平衡常数增大
B.当c(A)︰c(B)︰c(C)=2︰1︰2 时,该反应即达到平衡状态
C.达到平衡状态后,若只升高温度,则C的物质的量浓度增大
D.4 s内,υ(B)=0.075 mol/(L ·s)
难度: 简单查看答案及解析
-
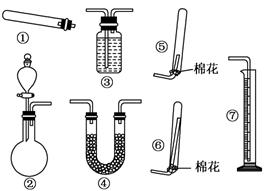
关于下列图示的说法中正确的是
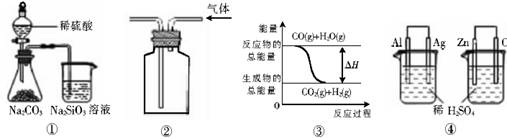
A.用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱
B.用图②所示实验装置排空气法收集CO2气体
C.图③表示可逆反应CO(g)+H2O(g)
CO2(g)+H2(g)的△H大于0
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同
难度: 简单查看答案及解析
-
一定物质的量的Al、Mg合金与适量的稀硫酸恰好完全反应,将反应后的溶液蒸干,所得固体(不含结晶水)质量比原固体增加了 7.2g,则该合金的物质的量可能为
A.0. 06mol B.0. 05mol C.0.08mol D.0.09mol
难度: 简单查看答案及解析
-
氧化铜和氧化铁的混合物a g,加入2mol·L-1的硫酸溶液50 mL,恰好完全溶解,若将a g的该混合物在过量的CO气流中加热充分反应,冷却后剩余固体的质量为
A. 1.6a g B.(a-1.6) g C.(a-3.2) g D.无法计算
难度: 简单查看答案及解析