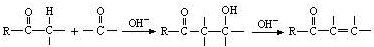-
我国晋代《抱朴子》中描述了大量的化学反应,其中有:①“丹砂(HgS)烧之成水银,积变又还成丹砂”; ②“以曾青涂铁,铁赤色如铜”。下列有关叙述正确的是
A.①中水银“积变又还成丹砂”说明水银发生了还原反应
B.②中反应的离子方程式为:2Fe+3Cu2+=2Fe3++3Cu
C.根据①可知温度计打破后可以用硫粉覆盖水银,防止中毒
D.水银能跟曾青发生置换反应生成单质铜
难度: 简单查看答案及解析
-
用NA表示阿伏伽德罗常数,下列说法正确的是
A.7.8gNa2O2中阴阳离子总数为0.4NA
B.2L0.01mol·L-1NaAlO2溶液中AlO2-的个数为0.02NA
C.4.6g钠充分燃烧时转移电子数为0.2NA
D.密闭容器中2molSO2与1molO2充分反应,产物的分子数为2NA
难度: 简单查看答案及解析
-
顺式乌头酸是一种重要的食用增味剂,其结构如下图所示。下列说法正确的是
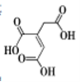
A.该有机物的分子式为:C6H8O6
B.该有机物只含有一种官能团
C.该有机物能使酸性KMnO4溶液、溴的四氯化碳溶液褪色,且原理相同
D.等物质的量的顺式乌头酸分别与足量的NaHCO3和Na反应,产生相同条件下的气体体积之比为2:1
难度: 中等查看答案及解析
-
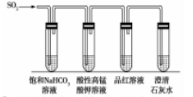
下列根据实验现象得出的结论正确的是
选项
实验操作
现象
结论
A
将SO2通入酸性KMnO4溶液中
紫色褪去
SO2具有漂白性
B
C2H5OH与浓硫酸混合后加热到170℃
生成的气体使酸性KMnO4溶液褪色
反应一定生成了乙烯
C
向KNO3和KOH混合溶液中加入铝粉并加热,管口放湿润的红色石蕊
试纸变为蓝色
NO3-被还原为NH3
D
向NaSiO3溶液中滴加I滴酚酞试液,然后逐滴加入稀盐酸至红色褪去
产生胶装沉淀
非金属性:Cl>Si
难度: 中等查看答案及解析
-
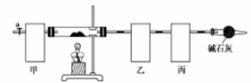
2015年11月30日第21届联合国气候大会在巴黎召开,会议的一项主题是温室气体减排。如图是科学家正在研发的实现CO2和H2合成甲醇的燃烧电池。下列叙述正确的是
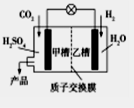
A.乙槽中反应生成水
B.甲槽中的电极反应式为:CO2+6e-+5H2O=CH3OH+6OH-
C.质子从乙槽通过质子交换膜进入甲槽
D.放电过程中,乙槽的电极附近溶液的pH升高
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与Y同主族。下列说法正确的是
A. Z元素的简单离子是其所在周期中元素的简单离子半径最小的
B. Y的简单气态氢化物的热稳定性比W的强
C. Y与W形成的化合物一定能使酸性高锰酸钾溶液褪色
D. 最高价氧化物对应水化物的酸性X比W的强
难度: 简单查看答案及解析
-
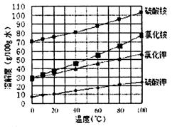
常温下,向1L0.1mol·L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如图所示(不考虑溶液体积变化和氨的挥发),下列说法正确的是
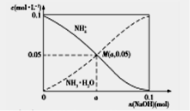
A.在M点时,n(OH-)-n(H+)=(a-0.05)mol
B.M点溶液中水的电子程度比原溶液的大
C.随着NaOH的加入,c(H+)/c(NH4+)不断增大
D.当n(NaOH)=0.mol时,c(OH-)=c(Cl-)-c(NH3·H2O)
难度: 困难查看答案及解析

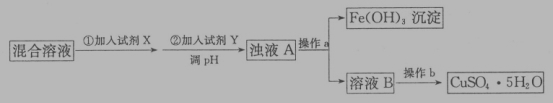
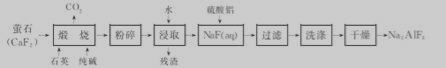
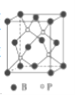
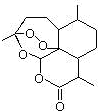
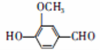 )可用于合成青蒿素,合成天然香草醛的反应如图:
)可用于合成青蒿素,合成天然香草醛的反应如图: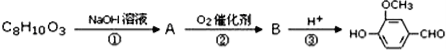
 是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。已知:羰基α-H可发生反应:
是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。已知:羰基α-H可发生反应: