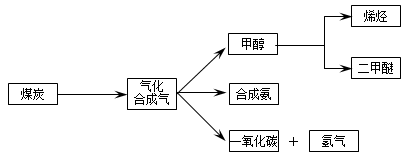
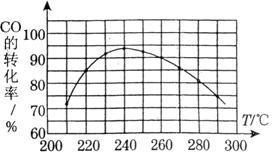
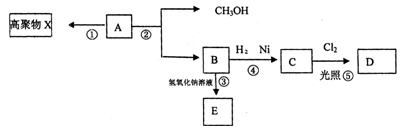
-
化学与环境、材料和科技等密切相关。下列说法中错误的是( )
A.积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料
B.光导纤维在信息产业中有广泛应用,制造光导纤维的主要材料是单质硅
C.即将到来的新能源时代,核能、太阳能和氢能等很可能成为主要能源
D .2011年11月3号1时43分神州八号与“天宫一号”完成了首次对接,神八在制造过程中使用了大量的复合材料
难度: 简单查看答案及解析
-
下列说法中,正确的是( )
A. 含金属元素的离子不一定是阳离子
B. 只有原子才满足核内质子数和核外电子数相等
C. 相同条件下,l molH原子所具有的能量小于0.5 mol H2所具有的能量
D. 蛋白质溶液、淀粉溶液和葡萄糖溶液都是胶体
难度: 简单查看答案及解析
-
下列选项中所涉及到的两个量一定相等的是( )
A.质量相等、体积不等的N2和C2H4的分子数
B.18.0 g重水(D2O)与20 g Ne所含有的电子数
C.等物质的量的Al分别与一定量的盐酸、NaOH溶液反应转移的电子数
D.100 mL 2.0 mol/L盐酸与100 mL 2.0 mol/L醋酸溶液中所含有的H+数
难度: 简单查看答案及解析
-
若NA代表阿伏加德罗常数,则下列叙述中,正确的是( )
A. 一定条件下,足量铜与200 g 98%的浓硫酸充分反应,转移电子数目为2NA
B. t℃时,1LpH=6的纯水中,含10-6NA个OH—
C. 1mol FeCl3溶于水转化为氢氧化铁胶体后,其中氯离子的数目小于3NA
D. 标准状况下,一定量的铜与硝酸反应后生成22.4 L NO、NO2、N2O4的混合气体,则被还原的硝酸的分子数为NA
难度: 简单查看答案及解析
-
在溶液中加入足量Na2O2后仍能大量共存的离子组是( )
A.NH4+、Ba2+、Cl-、NO3- B.K+、AlO2-、Cl-、SO42-
C.Ca2+、Mg2+、NO3-、HCO3- D.Na+、Cl-、CO32-、SO32-
难度: 简单查看答案及解析
-
下列离子方程式中书写正确的是( )
A.酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH-
B.NaHCO3的水【解析】
HCO- 3+H2OH3O++CO2- 3
C.向醋酸钠溶液中通入少量的二氧化碳:2CH3COO- + CO2 + H2O=2CH3COOH+CO32-
D.KI溶液与H2SO4酸化的H2O2溶液混合:2 I- + H2O2 + 2 H+ =2 H2O + I2
难度: 简单查看答案及解析
-
分子式为C7H8的某有机物,它能使酸性高锰酸钾溶液褪色,但不能与溴水反应。在一定条件下与H2完全加成,加成后其一氯代物的同分异构体有( )
A.3种 B.4种 C.5种 D.6种
难度: 简单查看答案及解析
-
下列装置不能完成的实验是( )

难度: 简单查看答案及解析
-
A、B、C为三种短周期元素,A、B在同周期,A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构。下列说法中,正确的是( )
A.原子序数:A>B>C B.原子半径:A>B>C
C.离子半径:A2->B2+>C- D.原子最外层电子数:A>C>B
难度: 简单查看答案及解析
-
类比(比较)是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的,不能违背客观实际。下列各说法中正确的是( )
A.根据化合价Fe3O4可表示为FeO·Fe2O3 ,则Pb3O4也可表示为PbO·Pb2O3
B.CaC2能水【解析】
CaC2+2H2O→Ca(OH)2 + C2H2↑ ,则Al4C3也能水【解析】
Al4C3 + 12H2O→4Al(OH)3↓+ 3CH4↑C.O2与Cu反应加热生成CuO,则S与Cu反应加热生成CuS
D.SO2通入BaCl2溶液中不产生沉淀,则SO2通入Ba(NO3)2溶液中也不产生沉淀
难度: 简单查看答案及解析
-
在10mL 0.01mol·L-1的纯碱溶液中,逐滴加入1.2mL 0.05mol·L-1的盐酸并不断搅拌,完全反应后在标准状况下生成二氧化碳的体积是( )
A.1.344mL B.2.240mL C.0.672mL D.0mL
难度: 简单查看答案及解析
-
在淀粉碘化钾溶液中加入少量次氯酸钠溶液,振荡,溶液变蓝。在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失。下列判断错误的是( )
A.氧化性:ClO->SO42->I2
B.漂白粉溶液可使淀粉碘化钾试纸变蓝
C.向新制氯水中加入足量亚硫酸钠溶液,氯水褪色
D.ClO-与I-在碱性条件可以发生氧化还原反应
难度: 简单查看答案及解析
-
对下列各溶液中,微粒的物质的量浓度关系表述正确的是
A. 某溶液中存在的离子只有Cl-、OH-、NH4+、H+,该溶液中离子浓度大小关系可能为c(Cl-)>c(NH4+) >c(OH-)>c(H+)( )
B. 在NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
C. 将相同物质的量浓度的某弱酸(A-为弱酸根)溶液与KA溶液等体积混匀,测得混合后溶液pH=10,则混合液中c(K+)>c(A-)
D. 0.1 mol·L-1 CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
难度: 简单查看答案及解析
-
下列表述中正确的是( )
A.任何能使熵值减小的过程都能自发进行
B.已知:2SO2(g)+O2(g)
2SO3(g):△H=-197kJ/mol.实验测得4molSO2参加上述反应放出354kJ热量,则SO2的转化率最接近于90%
C.在Na2SO4溶液中加入过量的BaCl2后,溶液中不存在SO42-
D.1mol NaOH分别和1mol CH3COOH、1molHNO3反应,后者比前者△H大
难度: 简单查看答案及解析
-
铁和氧化铁的混合物共a mol,加盐酸后固体全部溶解,共收集到b mol氢气,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中铁的物质的量为( )
A.
(a+b) mol B. (a-b) mol C.
(a-b)mol D. (a+b) mol
难度: 简单查看答案及解析
-
(6分) 常温下,浓度均为0.1mol·L-1的六种溶液的pH如下表:
溶质
CH3COONa
NaHCO3
Na2CO3
NaClO
NaCN
Na2SO4
pH
8.8
9.7
11.6
10.3
11.1
7.0
①上述盐溶液中的阴离子,结合质子能力最强的是 .
②根据表中数据,浓度均为0.01mol·L-1的下列五种物质的溶液中,酸性最强的
是 (填字母);将各溶液分别稀释100倍,pH变化最小的是 (填字母).
A.HCN B.HClO C.H2SO4 D.CH3COOH E.H2CO3
难度: 简单查看答案及解析
-
下列微粒中,对水的电离平衡不产生影响的是( )

难度: 简单查看答案及解析