-
下列化学药品与其危险化学品图形标志不一致的一组是
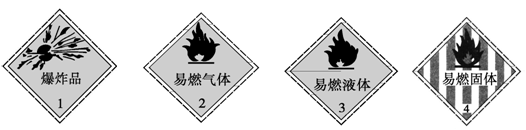
A.烧碱—1 B.甲烷—2 C.酒精—3 D.白磷—4
难度: 简单查看答案及解析
-
下列实验操作或记录正确的是
A.用两只250 mL的容量瓶配制0.1 mol/L 500 mL的NaOH溶液
B.用量筒测得排水法收集制得的氢气体积为50.28 mL
C.常温常压下测得1 mol N2的质量为28 g
D.用托盘天平称得2.50 g胆矾,受热充分失水后,固体质量减轻0.90 g
难度: 中等查看答案及解析
-
需要加入适当的氧化剂才能实现的反应
A.PCl3→PCl5 B.MnO4-→Mn2+ C.SO3→SO42- D.CO2→CO32-
难度: 中等查看答案及解析
-
下列说法中,正确的是
A.SO2水溶液能导电,所以SO2是电解质
B.Na2CO3既是钠盐又是碳酸盐
C.向醋酸溶液中加入少量氢氧化钠固体,由于发生中和反应,溶液的导电能力降低
D.NaCl溶液能导电所以NaCl溶液是电解质
难度: 中等查看答案及解析
-
下列溶液中,物质的量浓度最大的是
A.将40 g NaOH溶于水并配成1 L的溶液 B.0.5 L含49 g H2SO4的溶液
C.将1mol Na2O 溶于水并配成1 L的溶液 D.含K+为1mol·L-1的K2SO4溶液
难度: 中等查看答案及解析
-
下列关于胶体的的叙述正确的是
A.向1 mol·L-1氯化铁溶液中加入少量的NaOH溶液制取氢氧化铁胶体
B.可以用丁达尔现象区别硫酸铜溶液和氢氧化铁胶体
C.氢氧化铁胶体通电后氢氧化铁胶粒向正极移动
D.由0.1mol氯化铁制取的氢氧化铁胶体中,氢氧化铁胶粒数目为0.1NA(设NA表示阿伏加德罗常数的值)
难度: 中等查看答案及解析
-
2.3 g钠投入100g水中,下列叙述述错误的是
A.钠浮在水面,熔化成银色光亮的小球 B.钠贮存在煤油中
C.所得溶液的质量分数为2.25﹪ D.反应中转移0.1mol电子
难度: 中等查看答案及解析
-
有甲、乙、丙三种溶液,进行如下操作:

则甲、乙、丙三种溶液可能是
A.BaCl2、H2SO4、MgCl2 B.CaCl2、HNO3、BaCl2
C.CaCl2、HNO3、NaCl D.BaCl2、HCl、Na2SO4
难度: 中等查看答案及解析
-
下列溶液Cl-的物质的量浓度与50 mL 1 mol·L-1氯化铝溶液中Cl-的物质的量浓度相等的是
A.150 mL 1 mol·L-1氯化钠溶液 B.75 mL 1.5 mol·L-1氯化钙溶液
C.150 mL 1 mol·L-1氯化钾溶液 D.50 mL 3 mol·L-1氯化镁溶液
难度: 中等查看答案及解析
-
下列说法正确的是
A.同温同压下甲烷(CH4)和氧气的密度之比为2∶1
B.1 g甲烷和1 g氧气的原子数之比为5∶1
C.等物质的量的甲烷和氧气的质量之比为2∶1
D.在标准状况下等质量的甲烷和氧气的体积之比为1∶2
难度: 中等查看答案及解析
-
为了除去FeCl2溶液中混有的少量FeCl3,最好的方法是向此溶液中
A.通入氯气 B.加入Zn C.加入Fe D.加入Cu
难度: 中等查看答案及解析
-
此反应:MnO2 +4 HCl(浓)
MnCl2 +Cl2↑+2H2 O,氧化剂和还原剂的物质的量比为
A.4∶1 B.1∶4 C.1∶1 D.1∶2
难度: 中等查看答案及解析
-
下列电离方程式错误的是
A.NaHCO3=Na++ H+ + CO32- B.NaOH=Na+ + OH-
C.H2SO4=2H+ + SO42- D.KCl=K+ + Cl-
难度: 简单查看答案及解析
-
下列叙述中正确的是
A.化合反应和置换反应均为氧化还原反应
B.碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物
C.电离出的阳离子是H+的物质一定是酸
D.能与酸反应的氧化物一定是碱性氧化物
难度: 中等查看答案及解析
-
已知常温下在溶液中可发生如下两个离子反应:
Ge4++Fe2+=Fe3++Ge3+ ①;Sn2++2Fe3+=2Fe2++Sn4+ ②
由此可以确定Fe2+、Ge3+、Sn2+三种离子的还原性由强到弱的顺序是
A.Sn2+、Fe2+、Ge3+ B.Sn2+、Ge3+、Fe2+
C.Ge3+、Fe2+、Sn2+ D.Fe2+、Sn2+、Ge3+
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法中正确的是
A.含0.1 mol BaCl2的溶液中Cl-数为0.1NA B.22 g CO2所含有的分子数为0.5NA
C.11.2 L CO2所含有的分子数为0.5NA D.常温下NA个Cl2分子所占有的体积为22.4 L
难度: 中等查看答案及解析
-
下列反应中氯元素仅被还原的是
A. 5Cl2+I2+6H2O=10HCl+2HIO3
B. 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
C.MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑
D.HCl+NaOH=NaCl+H2O
难度: 中等查看答案及解析
-
下列离子方程式,正确的是
A.氢氧化铁与盐酸反应:H++OH-=H2O
B.过量NaHSO4溶液与少量Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
C.铁与H2SO4反应:Fe+2H+=Fe3++H2↑
D.CaCO3溶于稀盐酸中:CO32-+2H+=CO2↑+H2O
难度: 中等查看答案及解析
-
(1)相同质量的SO2、SO3的物质的量之比为____________;氧原子的个数之比为_ _______。
(2)19 g某二价金属氯化物(ACl2)中含有0.4 mol Cl-,则ACl2的摩尔质量是________;A的相对原子质量是____________;ACl2的化学式是__________。
难度: 中等查看答案及解析