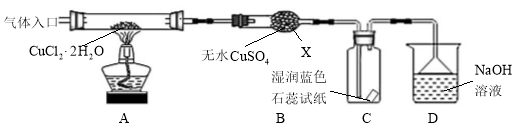
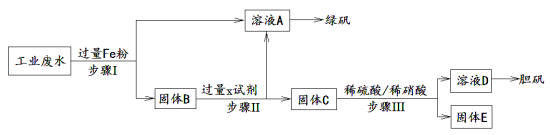
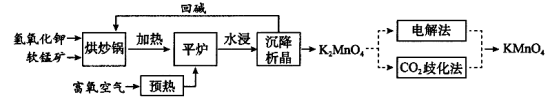
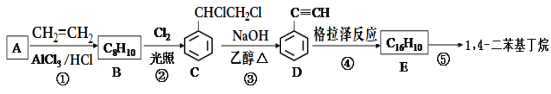
-
已知:NA表示阿伏加德罗常数,则下列说法不正确的是
A.31g白磷分子中所含p—p共价键数目为1.5NA
B.标准状况下,2.24LD2中所含中子的数目是0.2NA
C.常温常压下42g乙烯和丙烯的混合气体含氢原子数目为6 NA
D.常温下,向1L0.2mol/L的盐酸溶液通入氨气,当溶液PH=7时,溶液中NH4+的数目小于0.2NA
难度: 中等查看答案及解析
-
某离子反应中共有H2O、ClO-、NH4+、H+、N2、Cl-六种微粒。其中c(ClO-) 随反应进行逐渐减小。下列判断错误的是( )
A.该反应的还原剂是NH4+
B.消耗1mol氧化剂,转移2mol电子
C.氧化剂与还原剂的物质的量之比是2:3
D.反应后溶液酸性明显增强
难度: 中等查看答案及解析
-
下列实验现象预测不正确的是( )
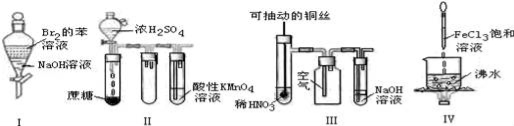
A.实验Ⅰ:振荡后静置,上层溶液变为无色
B.实验Ⅱ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去
C.实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D.实验Ⅳ:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.将NO2气体通入NaOH溶液中:3NO2+2OH-=2NO3-+NO↑+H2O
B.将铁丝插入过量的稀硝酸中:Fe+4H++NO3-=Fe3++NO↑+2H2O
C.IBr和Cl2的化学性质相似,将IBr通入NaOH溶液中:IBr+2OH-=I-+BrO-+H2O
D.Na2S溶液通入足量SO2气体:2S2-+SO2+2H2O=3S↓+4OH-
难度: 中等查看答案及解析
-
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是( )
选项
叙述Ⅰ
叙述Ⅱ
A
浓硝酸和稀硝酸都具有强氧化性
浓硝酸和稀硝酸均可使紫色石蕊试液先变红后褪色
B
浓硫酸具有强氧化性和吸水性
浓硫酸可干燥H2和CO,不可干燥 SO2和NH3
C
SO2是酸性氧化物
SO2可使含有酚酞的NaOH溶液褪色
D
铵盐受热易分解
NH4Cl和NH4HCO3均可用作氮肥和制取氨气
难度: 中等查看答案及解析
-
我国有广阔的海岸线,建设海峡经济区,海水的综合利用大有可为,下图所示为海水综合利用部分流程,有关说法正确的是( )
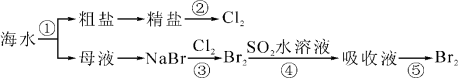
A.上述工艺流程中涉及到化合、分解、复分解和置换反应
B.①只发生了化学变化,②是工业上用电解熔融NaCl制备Cl2
C.③④涉及的反应均为氧化还原反应,⑤只需要蒸馏即可得到单质Br2
D.④中反应的离子方程式为SO2+Br2+2H2O===4H++SO42-+2Br-
难度: 困难查看答案及解析
-
3.87克锌铜合金完全溶解于150mL、密度为1.20g/cm3、质量分数为21%的稀硝酸中,得到NO气体896mL (标准状况),向反应后的溶液中加入适量的1.0mol/LNaOH溶液,恰使溶液中的金属离子全部沉淀。下列说法不正确是( )
A.该稀硝酸中HNO3的物质的量浓度是4.0mol/L
B.加入NaOH溶液的体积是560mL
C.被还原的硝酸的物质的量为0.04mol
D.得到的金属氢氧化物的沉淀为5.81克
难度: 极难查看答案及解析