-
下列溶液中各微粒的浓度关系正确的是
A.等pH值的氨水、KOH溶液、Ba(OH)2溶液中: c(NH4+)=c(K+)=2c(Ba2+)
B.0.1 mol/L 的CH3COONa溶液中: c(CH3COO-) > c(Na+) >c(OH-) >c(H+)
C.常温时向NH4HSO4溶液中滴加NaOH溶液至pH=7:c(NH4+)+c(Na+)= c(SO42-)
D.将10 mL 0.1 mol/L Na2CO3溶液逐滴滴加到10 mL 0.1 mol/L盐酸中:
c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)
难度: 中等查看答案及解析
-
对于工农业生产和日常生活中与化学有关的问题,下列认识不正确的是
A:冬季形成的大雾属于气溶胶
B:纯净的二氧化硅是现代光学及光纤制品的基本材料
C:铝合金的大量使用是因为人们能用焦炭等还原剂从氧化铝中获取铝
D:含有氯化钠融雪剂的使用会加快桥梁的腐蚀
难度: 简单查看答案及解析
-
下列有关物质分类或归纳的说法中,正确的一组是
①蔗糖和麦芽糖的化学式都可用C12H22O11表示,它们互为同分异构体
②聚乙烯、聚氯乙烯、纤维素都属于合成高分子
③明矾、石膏、冰醋酸、水都是电解质 ④盐酸、漂白粉、水玻璃都是混合物
⑤分馏、干馏、裂化都是化学变化 ⑥植物油、直馏汽油都可与溴水反应
A.①③⑤ B.②④⑥ C.②⑤⑥ D.①③④
难度: 简单查看答案及解析
-
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中W的原子核内质子数与核外最外层电子数之比为8:3,下列说法正确的是
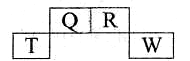
A.T的离子半径大于W的离子半径
B.RHn,在同族元素的气态氢化物中沸点最低
C.Q与W的原子能形成非极性分子
D.在R的最高价氧化物对应水化物的浓溶液中单质T不溶解,说明未发生化学反应
难度: 简单查看答案及解析
-
水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32—+O2+aOH—=Y+S4O62—+2H2O;下列说法中不正确的是
A:S2O32—是还原剂 B:Y的化学式为Fe2O3
C:a=4 D:每有1mol O2参加反应,转移的电子总数为4mol
难度: 简单查看答案及解析
-
常温下,将一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的PH如下表:
实验编号
c(HA)/mOl·L-1
c(NaOH)/m01·L-1
混合溶液的pH
甲
0.1
0.1
pH=a
乙
0.2
0.2
pH=9
丙
C1
0.2
pH=7
丁
0.2
0.1
pH<7
下列判断正确的是
A.a>9 B.在乙组混合液中c(OH-)一c(HA)=10-9mol/L
C c1=0.2 D.在丁组混合液中c(Na+)>c(A—)
难度: 简单查看答案及解析
-
绿原酸是咖啡的热水提取液的成分之一,绿原酸结构简式如图,下列关于绿原酸判断不正确的是
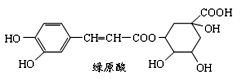
A.绿原酸既可以催化加氢,又可以使酸性KMnO4溶液褪色
B.绿原酸的官能团中有羧基
C.1mol绿原酸与足量NaOH溶液反应,最多消耗3mol NaOH
D.绿原酸可以与FeCl3溶液发生显色反应
难度: 简单查看答案及解析
-
溶液中的反应
分别在①、②、③三种不 同实验条件下进行,它们的起始浓度均为c(X)=c(Y)=0.100mol/L及c(Z)=0mol/L,反应物x的浓度随时间变化如右图所示。②、③与①比较只有一个实验条件不同,下列说法不正确的是
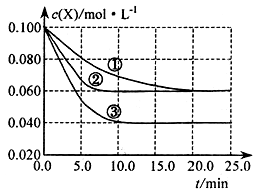
A.反应进行到5min时实验③的反应速率最快
B.条件②的反应最先达到平衡
C.②与①比较可能是压强更大
D.该反应的正反应是吸热反应
难度: 简单查看答案及解析

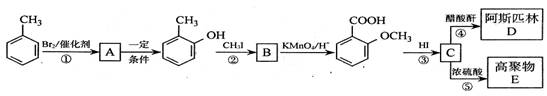
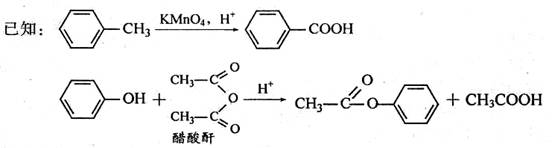
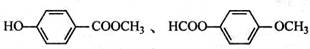 、
、