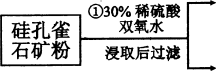
-
下列过程没有发生化学反应的是
A.用氢氟酸来刻蚀玻璃器皿 B.用活性炭去除冰箱中的异味
C.用煤液化和气化得到清洁燃料 D.用热碱溶液清除炊具上残留的油污
难度: 中等查看答案及解析
-
下列关于物质分类的说法正确的是
A.醋酸、氨水、硫酸钡均属于弱电解质
B.铜合金、铝合金、钢铁均属于金属材料
C.动物油、植物油、矿物油均属于酯类化合物
D.稀豆浆、稀盐酸、硅胶均属于胶体
难度: 中等查看答案及解析
-
下列关于化学用语的表示正确的是
A.碘化铵的电子式:
B.间二甲苯的结构简式:
C.中子数为146、质子数为92的铀(u)原子:
D.氯原子的结构示意图:
难度: 中等查看答案及解析
-
下列说法合理的是
A.金属锂、镁在氧气中燃烧的产物分别为Li2O、MgO
B.H—F、H—O、H—N三个共价键的极性逐渐增强
C.若X+和Y2-的核外电子层结构相同,则元素电负性X>Y
D.邻羟基苯甲醛沸点高于对羟基苯甲醛是因为形成了分子内氢键
难度: 中等查看答案及解析
-
下列条件中关于粒子组共存的评价不正确的是
选项
条件
粒子组
评价
A
含FeCl3的溶液中
H+、H2O2、Cl-
会发生反应,所以不能大量共存
B
室温时,pH=ll的溶液中
Na+、ClO-、AlO2-
能大量共存
C
水电离的c(H+)=1×10-6mol/L的溶液中
Al3+、NH4+、NO3-
可能大量共存
D
某无色溶液中
Na+、HCO3-、OH-
会产生CO2,所以不能大量共存
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.1.7 g羟基所含电子的数目为NA
B.0.1 mol丙烯醛中含有双键的数目为0.1NA。
C.室温时,pH=13的1.0L Ba(OH)2溶液中含有OH-的数目为0.2NA
D.标准状况下,7.8 g苯中含氢原子的数目为0.6NA
难度: 中等查看答案及解析
-
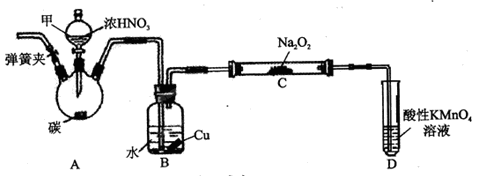
用下列装置进行的实验中,能达到其实验目的的是.

A.用装置①制取并收集干燥纯净的NH3
B.用装置②分离苯萃取碘水后已分层的有机层和水层
C.用装置③配制一定的物质的量浓度的稀硫酸
D.用装置④测定锌与稀硫酸反应的速率
难度: 中等查看答案及解析
-
X、Y、Z、W为四种短周期主族元素,它们在周期表中的位置如右图所示。X的最高价氧化物和气态氢化物的分子都是由极性键形成的非极性分子。下列性质比较中正确的是
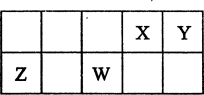
A.最高价氧化物的水化物的酸性:Y<X<W
B.离子半径由小到大的顺序:W<Z<Y
C.单质晶体的熔点由低到高的顺序:Y<W<Z
D.原子最外层的电子数:Z<Y<X
难度: 中等查看答案及解析
-
下列图示与对应的叙述不相符的是
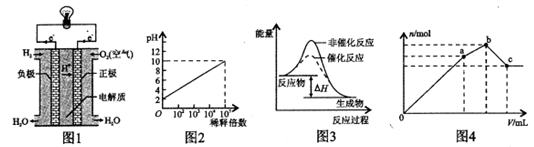
A.图1表示氢氧燃料电池构造示意图
B.图2表示室温下pH=2的HCl溶液加水稀释倍数与pH的变化关系
C.图3表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
D.图4表示向NH4 Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,生成沉淀总物质的量(n)随着Ba(OH)2溶液体积(y)的变化
难度: 中等查看答案及解析
-
已知甲、乙、丙三种物质均含有同一种中学常见元素X,其转化关系如下:
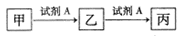
下列说法不正确的是
A.若乙为NaHCO3,则丙一定是CO2
B.若A为氯水,X为金属元素,则甲与丙反应可生成乙
C.若A为NaOH溶液,X为短周期的金属元素,则乙一定为白色沉淀
D.若甲为单质硫,则丙溶于水形成的浓溶液能与碳反应可生成乙
难度: 中等查看答案及解析
-
室温下,取0.2mol/L H2 A溶液与xmol/L NaOH溶液等体积混合(忽略混合后溶液体积变化),测得混合溶液的pH=y,下列推断不正确的是
A.当x=0.2,则混合溶液中y可能大于7或小于7
B.当x=0.2,y=1,则混合溶液中:c(H+)=c(A-)+c(OH-)
C.当x=0.3,y>7,则混合溶液中:c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
D.当x=0.4,则混合溶液中:[c(Na+)+c(H+)]>2c(A2-)
难度: 中等查看答案及解析
-
工业上正在研究利用CO2来生产甲醇燃料,该方法的化学方程式为CO2(g)+3H2(g)
CH3OH(g)+H2O(g) ∆H=-49.0kJ/mol,一定温度下,在三个容积均为3.0L的恒容密闭容器中发生该反应:
容器
起始物质的量/mol
平衡物质的量/mol
编号
温度/℃
CO2(g)
H2(g)
CH3OH(g)
H2O(g)
Ⅰ
T1
3
4
0.5
0.5
Ⅱ
T1
1.5
2
Ⅲ
T2
3
4
0.8
0.8
下列有关说法不正确的是
A.若经过2min容器I中反应达平衡,则2min内平均速率V(H2)=0.25 mol/(L·min)
B.达到平衡时,容器I中CO2转化率的比容器Ⅱ的大
C.达到平衡时,容器Ⅲ中反应放出的热量比容器Ⅱ的2倍少
D.若容器Ⅰ、Ⅱ、Ⅲ中对应条件下的平衡常数分别为K1、K2、K3,则K1=K2<K3
难度: 中等查看答案及解析
-
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO32-。向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如右图所示,下列说法正确的是
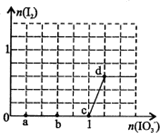
A.a点反应的还原剂是NaHSO3,被氧化的元素是碘元素
B.b点反应的离子方程式是:3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O
C.c点到d点的反应中共转移0.6mol电子
D.往200mL 1 mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式是:5HSO3-+ 2IO3- =I2+5SO42-+3H++H2O
难度: 中等查看答案及解析
-
向一定量的Cu、Fe2O3的混合物中加人600mL 2mol/L的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+,再加入过量1 mol/L NaOH溶液,将沉淀过滤、洗涤、干燥,称得质量比原混合物增重17.6g,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量是
A.4.8 g B.8.8 g C.9.6g D.14.4g
难度: 中等查看答案及解析