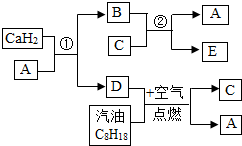
-
(2010•盐城)下列做法存在安全隐患的是( )
A.炒菜时油锅着火,立即盖上锅盖 B.厨房内闻到较浓的燃气味,立即关闭阀门并开窗通风 C.电器着火用水扑灭 D.手持燃着的蜡烛进入深洞游览,发现浊光变弱或熄灭立即退出 难度: 中等查看答案及解析
-
(2011•大庆)下表列出了除去物质中所含少量杂质的方法,其中不正确的是( )
选项 物质 所含杂质 除去杂质的方法 ① N2 O2 将气体缓缓通过足量的灼热铜网 ② CaO CaCO3 加水溶解、过滤 ③ Cu Zn 加入过量的稀盐酸,过滤,洗涤,干燥 ④ FeCl2 CuCl2 加入过量的铁粉 A.① B.② C.③ D.④ 难度: 中等查看答案及解析
-
(2010•常州)下列各组离子在溶液中一定能大量共存的是( )
A.Na+、Cl-、OH- B.K+、Ca2+、CO32- C.H+、Cl-、CO32- D.Na+、Fe3+、OH- 难度: 中等查看答案及解析
-
(2010•徐州)从化学角度看,下列叙述正确的是( )
A.海水晒盐属于化学变化 B.电动车充电是化学能转变为电能 C.不锈钢属于复合材料 D.燃油以雾状喷出有利于完全燃烧 难度: 中等查看答案及解析
-
(2010•常州)在一定条件下,下列转化不能由一步反应实现的是( )
A.Fe2O3→FeCl2 B.H2CO3→CO2 C.CuCl2→Cu D.Mg→MgO 难度: 中等查看答案及解析
-
2011年3月1日,卫生部等多部门发公告,自2011年5月1日起,禁止生产、在面粉中添加食品添加剂过氧化苯甲酰、过氧化钙增白剂,其中过氧化钙又名二氧化钙,则其化学式为( )
A.CaO2 B.CaO C.Ca2O2 D.Ca2O 难度: 中等查看答案及解析
-
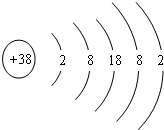
有探测资料表明,火星上存在丰富的镁资源.在元素周期表中,镁元素的某些信息如图所示,下列说法不正确的是( )
A.镁元素原子的核电荷数为12 B.镁元素属于非金属元素 C.镁元素原子的核外电子数为12 D.镁元素的相对原子质量为24.31 难度: 中等查看答案及解析
-
(2010•南京)薄荷醇(化学式为C10H20O)可用于糖果、饮料的香.下列有关薄荷醇的说法正确的是( )
A.薄荷醇不属于化合物 B.薄荷醇由10个碳原子、20个氢原子和1个氧原子构成 C.薄荷醇中碳元素、氢元素和氧元素的质量比为10:20:1 D.薄荷醇中碳元素的质量分数约为76.9% 难度: 中等查看答案及解析
-
2011年2月,一则“内地‘皮革奶粉’死灰复燃,长期食用可致癌”的新闻引起了网友们的广泛关注.食品与健康息息相关,下列作法不会危害人体健康的是( )
A.用甲醛浸泡黑木耳 B.使用聚苯氯乙烯做食品的包装袋 C.蒸馒头加适量纯碱 D.香肠中加过量的亚硝酸钠 难度: 中等查看答案及解析
-
下列是四位同学分别设计的实验方案,你认为可行的是( )
A.某白色固体化合物溶于水,向所得的无色溶液中滴入几滴酚酞试剂,溶液呈红色,证明该白色固体化合物一定是碱 B.向某固体中滴加盐酸,有气泡产生,该固体一定是金属 C.把燃着的木条插入某瓶无色气体中,木条火焰熄灭,证明瓶中的气体一定是二氧化碳 D.不用其他试剂就可鉴别氢氧化钠、氯化铁、硫酸铜和氯化钠四种溶液 难度: 中等查看答案及解析